MONOÁCIDOS EM ÁGUA
Dada a equação de ionização de um monoácido:

Constante de ionização gerada (Ka) e grau de ionização (α) para o ácido.

Como as demais constantes de equilíbrio, os valores de Ka só variam com a temperatura. Quanto maior o valor de Ka, maior o grau de ionização, α, do ácido; portanto, maior a sua força.
Exemplo: qual dos ácidos é mais forte?

O ácido mais forte será o ácido acético (CH3COOH) pois está mais ionizado no meio, apresentando assim um valor de α, demonstrando ser um ácido mais forte com o aumento da constante de acidez. O ácido mais fraco será o ácido sulfídrico (H2S) pois está menos ionizado, possuindo um menor valor para o grau de ionização e um menor valor para a constante de ionização.
ADIÇÃO DE UM MONOÁCIDO FORTE EM ÁGUA
Ácidos fortes se dissociam completamente em água (= 100%). Nesse caso, só haverá o equilíbrio iônico da água, pois o ácido está 100% ionizado. A [H+] existente no equilíbrio será majoritariamente do ácido, considerando-se que Kw = 10-14 e a de um ácido forte Ka > 10-2.
Exemplo: sabendo que α HC𝓁 ≫ H2O, tem-se que:

Considere a adição de mais HC𝓁 ao sistema. Observe que a adição de íon C𝓁- não perturbará o equilíbrio. A presença de H+, porém, fará com que a reação seja deslocada para a esquerda, fazendo a [OH–] diminuir, < 10-7 mol/L (o que mantém Kw constante e igual 10-14). Restabelecido o equilíbrio, tem-se [H+] > [OH–] onde se justifica meio aquoso ácido.
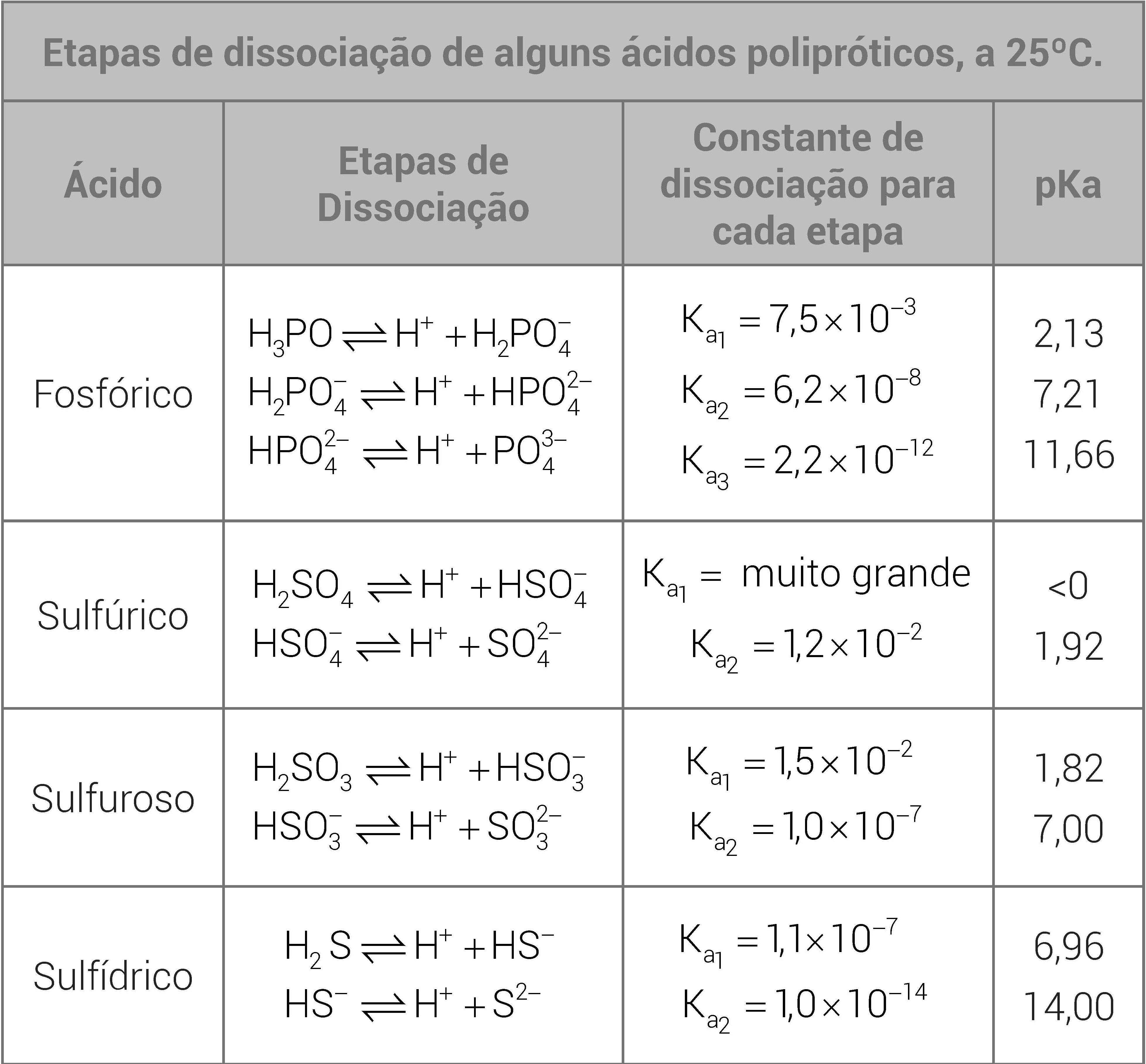
POLIÁCIDOS EM ÁGUA
Os ácidos que contém mais de hidrogênio ionizável são conhecidos como ácidos polipróticos. Alguns exemplos de ácidos polipróticos são o H2SO4 e o H2S, os quais possuem dois hidrogênios ionizáveis, e o H3PO4, que conta com três. Considera-se que esses ácidos têm seus hidrogênios ionizados um de cada vez. Assim, para cada etapa de ionização de um ácido é definido um valor de Ka e de α.
Exemplo: há duas etapas para a dissociação do ácido sulfúrico, cada uma com a equação correspondente ao seu Ka,

A primeira etapa sempre ocorre com muito mais intensidade, ou seja, Ka1 será muito maior que o das demais etapas. O Ka da etapa global, porém, será igual ao produto dos K relacionados a cada etapa.
De maneira geral, para ácidos com α1 < 5%, despreza-se a produção de íons H+ oriundos das próximas ionizações.