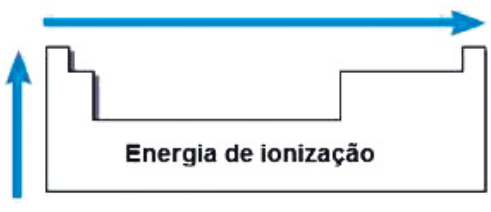
ENERGIA (OU POTENCIAL) DE IONIZAÇÃO
X(g) + [1a Energia de Ionização] → X+(g) + e−
X+(g) + [2a Energia de Ionização] → X2+(g) + e−
X2+(g) + [3a Energia de Ionização] → X3+(g) + e−
Exemplo:
Energias de ionização do carbono em Kcal x mol-1:
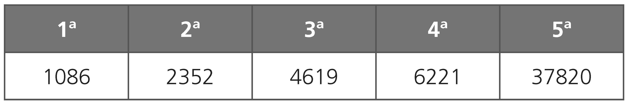
Podemos observar que a energia de ionização seguinte é sempre maior do que a energia de ionização anterior. Esse fato é comum a todos os elementos devido ao aumento da força de atração exercida pelo núcleo do átomo aos elétrons que ainda permaneceram no mesmo.
Outro fator que deve ser destacado, no caso do carbono, e comum aos demais elementos de sua coluna é um aumento exagerado entre os valores da ª4ª e da ª5ª energias de ionização. Os valores mais modestos para as quatro primeiras energias de ionização se deve ao fato de esses serem elétrons de valência do mesmo, já o quinto elétron, deve ser retirado da configuração de um gás nobre que apresenta forte blindagem, aumentando de forma considerável o valor da ª5ª energia de ionização.
Esse fato permite localizar a coluna dos elementos químicos, comparando os valores ao aumento de suas energias de ionização.
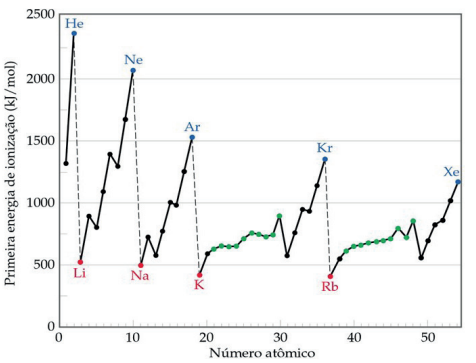
Crescimento da 1ª Energia de Ionização ao longo da Classificação Periódica