Eletrólise em solução aquosa
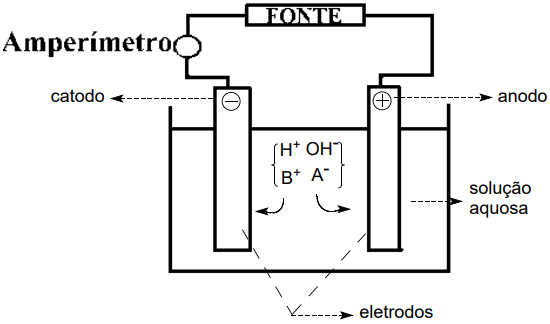
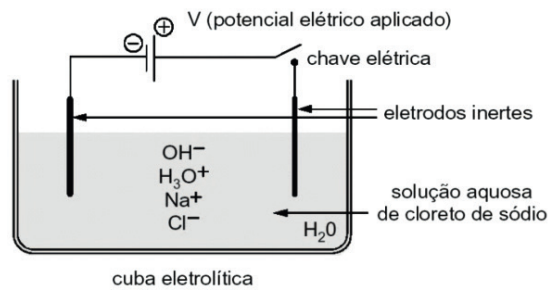
Exemplo: eletrólise aquosa do cloreto de sódio com uso de eletrodos inertes.

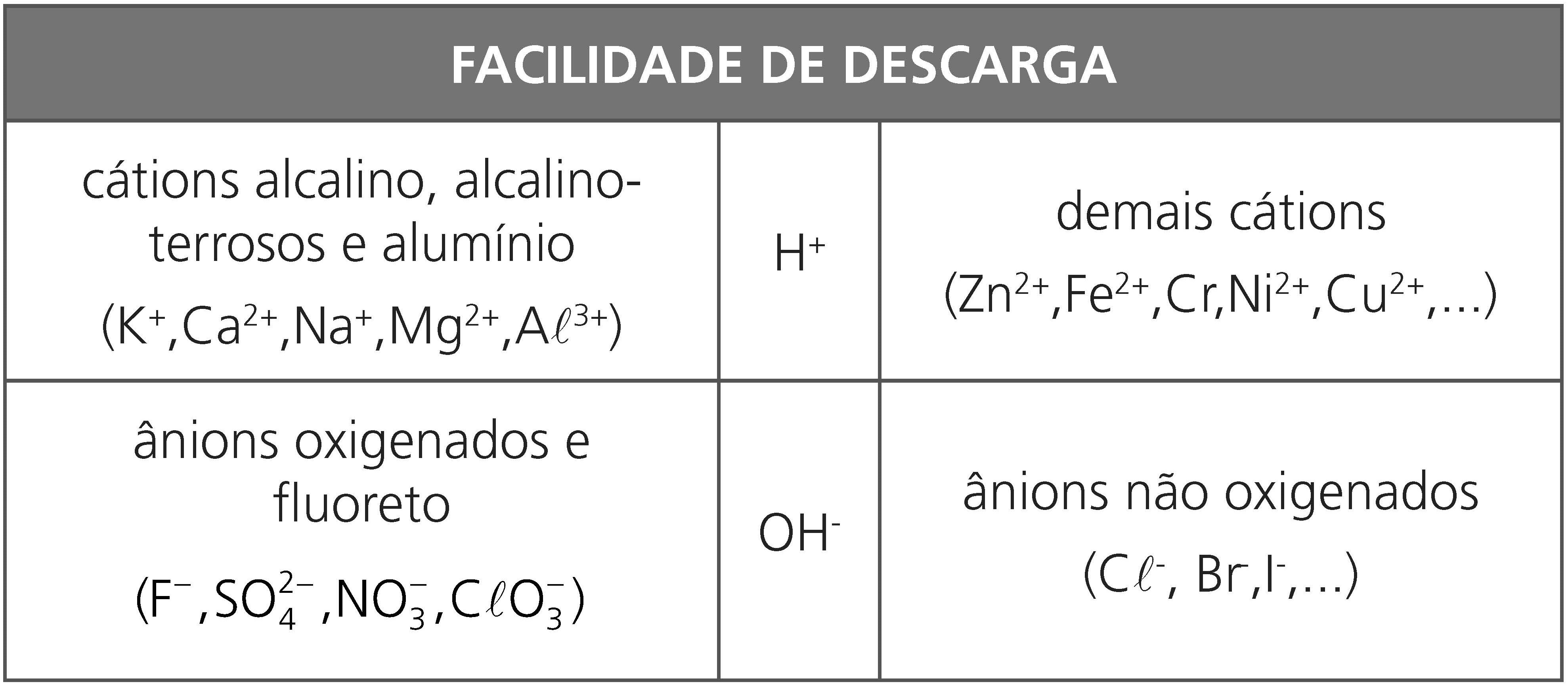
Observação:
Em eletrólises de compostos que apresentam ânions oxigenados, o íon hidroxila tem preferência de sofrer descarga produzindo o gás oxigênio segundo a semirreação:

Quando o eletrodo não é inerte, deve-se levar em conta a sua semirreação de oxidação, quando este estiver ligado no anodo, resultando na sua corrosão com seus íons migrando para a solução ou a sua semirreação de redução, quando este estiver ligado no catodo, resultando no seu ganho de massa devida a uma possível redução de seus íons migrando da solução para a placa metálica.
Técnicas de proteção de peças metálicas com uma camada de um metal com maior resistência a corrosão é demasiadamente empregada para diversas utilidades. Delas, destacamos os “banhos” de cromo (cromagem), de níquel (niquelagem), de ouro (auragem) e de prata.
PURIFICAÇÃO ELETROLÍTICA DO COBRE
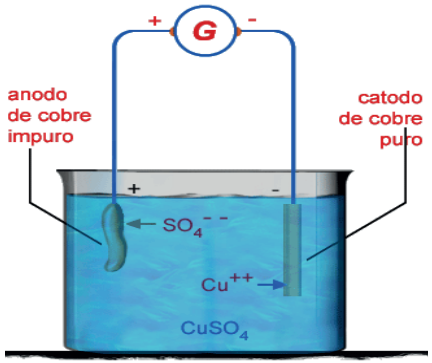
Metais presentes no anodo, que apresentam potencial de redução maior do que cobre (mais nobres), depositam-se na chamada “lama anódica”. Esses metais como ouro e prata, por exemplo, podem ser separados e posteriormente vendidos devido ao seu grande valor de mercado.




