O eletrodo escolhido como padrão foi o de hidrogênio, ao qual foi atribuído um potencial (Eº), igual a zero. A seguir, tem-se uma representação de um eletrodo de hidrogênio:
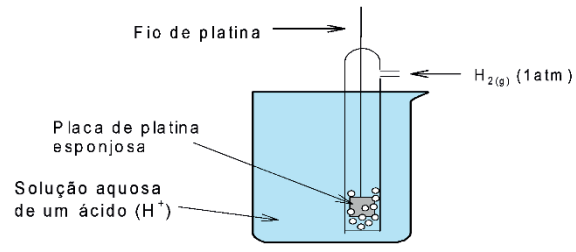
As semi-reações para esse eletrodo são:
Oxidação: H2(g) → 2H+(aq) + 2e–
Redução: 2H+(aq) + 2e– → H2(g)
A fim de tornar possível convencionar o potencial-padrão, de hidrogênio igual a zero (0,00 V), algumas condições foram estabelecidas:
Concentração de H+(aq) = 1 mol/L
Temperatura = 25°C
Pressão do H2(g) = 1 atm
Ou seja, são considerados eletrodos em condições-padrão aqueles que apresentarem soluções aquosas 1 mol/La 25°C e 1 atm.
DETERMINAÇÃO DO POTENCIAL-PADRÃO
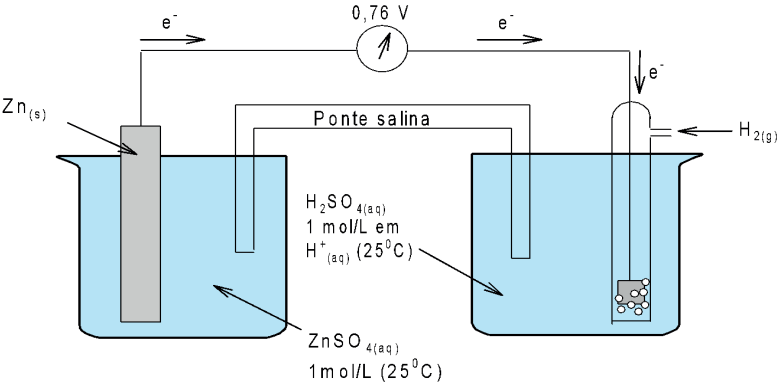
Como o voltímetro indica 0,76 V, e o potencial-padrão do hidrogênio é 0,00 V, conclui-se que o potencial medido é do zinco.
Ainda analisando a pilha, nota-se que os elétrons fluem do eletrodo de zinco para o eletrodo de hidrogênio, ou seja, o zinco se oxida (Znº → Zn2+ + 2e–) e o hidrogênio se reduz (2H+ + 2e– → H2).
Assim, a tendência do zinco em se reduzir é menor que a do hidrogênio, surgindo os potenciais-padrão de eletrodo.
Potencial-padrão (Eº) de redução do zinco =- 0,76 V.
Os potenciais-padrão de redução negativos pertencem às espécies que se reduzem com mais difi culdade (ou se oxidam com mais facilidade) do que o hidrogênio.
Os potenciais-padrão de redução positivos pertencem às espécies que se reduzem com mais facilidade (ou se oxidam com mais difi culdade) do que o hidrogênio.
Também é possível que seja apresentado o potencial de oxidação. A única diferença entre esses potenciais é o sinal.
Exemplo:
Potencial-padrão de redução do zinco (Eºred) = – 0,76 V
Potencial-padrão de oxidação do zinco (Eºoxi) = + 0,76 V
Hoje, por uma determinação da IUPAC, são utilizados apenas potenciais-padrão de redução.
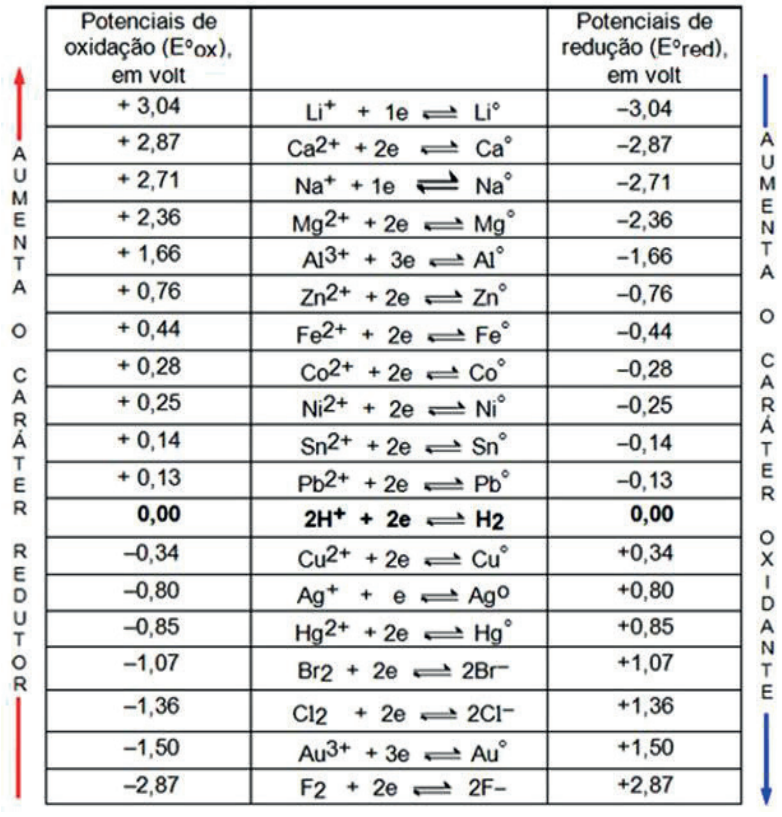
TABELA DE POTENCIAL – PADRÃO DE ELETRODO (E°)
São valores que usam o eletrodo padrão de hidrogênio como eletrodo de referência.
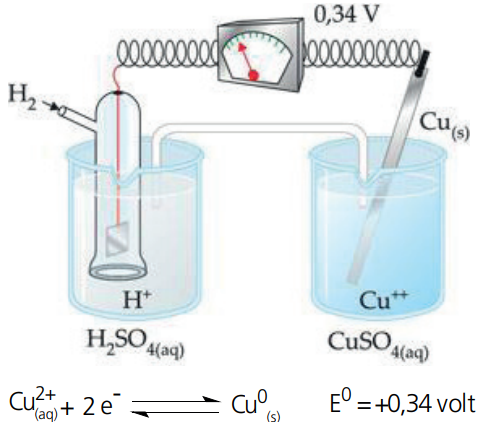
Numa Pilha: E(catodo) > E(anodo)
CÁLCULO DA FORÇA ELETROMOTRIZ (FEM) DAS PILHAS (∆Eº)
Também chamada de ddp, o ∆Eº representa a diferença entre os potenciais-padrão de redução dos eletrodos que constituem a pilha.
ΔE = E(sofre redução) – E(sofre oxidação)
Como as pilhas envolvem processos espontâneos, o potencial de redução do oxidante (se reduz) será sempre maior que o potencial de redução do redutor (se oxida). Assim, ∆Eº ganhará sempre um valor positivo. O valor da ddp permite determinar se o processo é espontâneo ou não espontâneo:
Processo espontâneo = ∆E > 0
Processo não espontâneo = ΔE < 0
REPRESENTAÇÃO DAS PILHAS
A pilha de Daniell pode ser representada como: Zn(s) / Zn2+(aq) // Cu2+(aq) / Cu(s).
A ordem utilizada para representar uma pilha é colocar primeiro a espécie que oxida, com sua variação de número de oxidação; em seguida, adicionar “//”, que indica a ponte salina; por fim, coloca-se a espécie que reduz.
METAL DE SACRIFÍCIO
Um metal de sacrifício é utilizado a fim de proteger outro metal, evitando sua corrosão. Normalmente, esse metal a ser protegido apresenta elevado poder de oxidação. Assim, o metal de sacrifício irá impedir a oxidação do metal protegido. Essa característica só é possível uma vez que esses metais de sacrifício apresentam potencial de redução menor do que o do metal a ser protegido.
Metais de sacrifício são muito utilizados em cascos de navios. Normalmente, esses navios são constituídos de ferro. O ferro, em contato com o ar e a umidade, se oxida, passando de Fe0 à Fe2+ levando à formação de ferrugem e, consequentemente, ao desgaste do material.





