São efeitos coligativos:
- Diminuição da pressão de vapor → Efeito Tonoscópico ou Tonoscopia
- Aumento da Temperatura de Ebulição → Efeito Ebulioscópico ou Ebulioscopia
- Diminuição da Temperatura de Congelamento → Efeito Crioscópico ou Crioscopia
- Aumento da Pressão Osmótica → Efeito Osmótico ou Osmoscopia
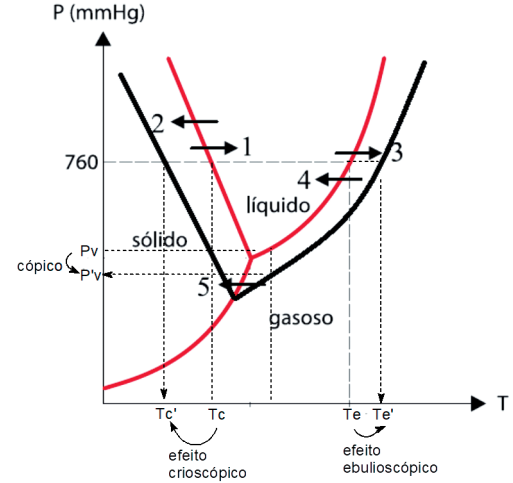
Observação: como o diagrama de fases nos revela, os efeitos Tonoscópico, ebulioscópico e crioscópico são simultâneos.
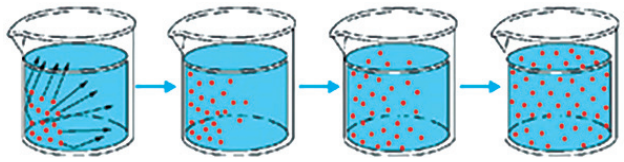
DIFUSÃO
É o deslocamento partículas de um meio de maior concentração para um meio de menor concentração. O fenômeno de difusão pode ser explicado pelo aumento de entropia, grau de desordem, espontânea dos sistemas físicos.
OSMOSE
É a difusão através de uma membrana semipermeável.
MEMBRANA SEMIPERMEÁVEL
Permite a passagem do solvente. Impede a passagem do soluto.
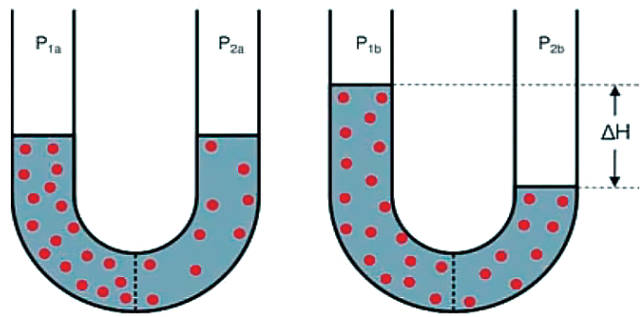
PRESSÃO OSMÓTICA (π)
A diferença de altura (DH) mostra que o solvente se deslocou para a coluna da esquerda e exerceu uma pressão osmótica (ππ).
EFEITOS COLIGATIVOS EM SOLUÇÕES IÔNICAS
O efeito coligativo de uma solução iônica é maior do que numa solução molecular que apresenta a mesma concentração molar inicial. Esse fato se deve pelo aumento do número total de partículas.
FATOR DE VAN’T HOFF (i)
E a razão entre o número de partículas do soluto, moléculas e íons presentes na solução, em equilíbrio, e o seu número de partículas iniciais. Considere as seguintes grandezas:
M0 → Concentração molar inicial da solução.
α → grau de ionização e/ou dissociação do soluto.
Para um soluto que se dissocia como a equação AxBy → (x)Ay+ + (y)Bx-, temos:
Concentração Molar total de partículas do soluto presentes na solução em equilíbrio (Mt):
Mt = M0 – M0α + xM0α + yM0α = M0{1 – [1- (x + y)]}, sendo i = Mt/M0
i = 1 + α(q – 1), onde:
α → grau de ionização e/ou dissociação do soluto.
q = (x) + (y) → soma do número de mols de íons.
Solução molecular → α = 0 → i = 1
Solução iônica totalmente dissociada → α = 1 → i = q
M[solução iônica] = M0 · (i)
EQUAÇÕES QUE SÃO CAPAZES DE MEDIR OS EFEITOS COLIGATIVOS
TONOMETRIA
Soluções Moleculares, sendo:
ΔP→redução da pressão de vapor.
ΔP/Po → redução relativa da pressão de vapor.
ΔP = P0 – P > 0

kt → constante tonoscópica (g ⋅ mol-1)

Exemplo: (kt)água = 0,018 g · mol-1.

EBULIOMETRIA
Soluções Moleculares, sendo:
∆te → aumento da temperatura de ebulição.
Teo → temperatura de ebulição do solvente puro.
Te → temperatura de ebulição da solução.
ΔTe = Te – Te0 > 0
ΔTe = Keb · W
Keb → constante ebulioscópica [(°C ou K) . Kg-1 . mol]

Lv → calor latente de vaporização do solvente (cal ⋅ g-1)
R → Constante Universal dos Gases → 2 cal ⋅ mol-1 ⋅ K-1
Exemplo: (Keb)água = 0,52°C · Kg-1 · mol
Soluções Iônicas: ΔTe = Keb · W · (i)
CRIOMETRIA
Soluções Moleculares, sendo:
∆Tc → redução da temperatura de congelamento.
Tco → temperatura de congelamento do solvente puro.
Tc → temperatura de congelamento da solução.
ΔTc = Tc° – Tc > 0
Kc→constante crioscópica [(°C ou K) . Kg -1.mol]

Lf → calor latente de fusão do solvente cal ⋅ g-1
Exemplo: (Kc)água = 1,86°C · Kg-1 · mol.
Soluções Iônicas: ΔTc = Kc · W · (i)
OSMOMETRIA
Soluções Moleculares, sendo:
π = M . R . T.
M → concentração molar da solução (mol ⋅ L-1).
R → Constante Universal dos Gases → 0,082 atm ⋅ L ⋅ mol-1 ⋅ K-1
T → Temperatura Absoluta (K)
Soluções Iônicas: π = M . R . T . (i)




