TIPOS DE DISPERSÕES
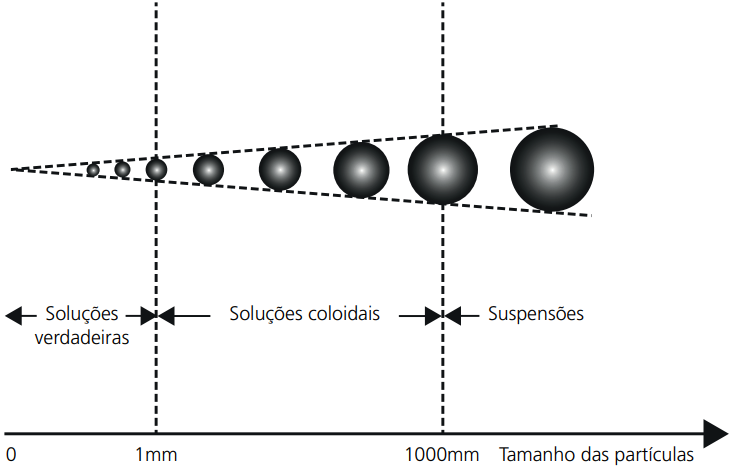
Dispersão é todo sistema no qual uma determinada substância distribui-se, uniformemente, em outra que está em maior quantidade. A substância em menor quantidade é chamada de disperso e a de maior quantidade dispersante. As dispersões se dividem em três casos: soluções, coloides e suspensões, que se diferem de acordo com o tamanho das partículas:
- Menores que 1 nm (nanômetro): soluções;
- Entre 1 e 100 nm: coloides;
- Maiores que 100 nm: suspensões.
SOLUÇÕES
São misturas de duas ou mais substâncias que apresentam aspecto uniforme, ou seja, formam um sistema homogêneo. As soluções são compostas por um ou mais solutos e por um solvente:
Solvente: substância capaz de dissolver a outra, e que normalmente está em maior quantidade;
Soluto: substância que irá ser dissolvida, e que normalmente está em menor quantidade.
SOLUÇÃO = SOLUTO + SOLVENTE
Exemplo:
Solução de NaC𝓁 (sal de cozinha) dissolvido em água. A água está em maior quantidade e dissolve o sal de cozinha; portanto, é o solvente. Já o sal de cozinha, que está sendo dissolvido, é o soluto.
Observação: a água é considerada o solvente universal, pois é utilizada como solvente no preparo da maioria das soluções.
TIPOS DE SOLUÇÕES
De acordo com o estado de agregação em que soluto e solvente se encontram, as soluções podem constituir um sistema sólido, líquido ou gasoso:
Soluções sólidas: os componentes em temperatura ambiente se encontram no estado sólido.Exemplo: liga de bronze, uma liga metálica composta, majoritariamente, de cobre e estanho.

Soluções líquidas: pelo menos um dos componentes deve estar em estado líquido na temperatura ambiente. Exemplo: refrigerante, que apresenta gás dissolvido em líquido.

Soluções gasosas: toda mistura de gases é uma solução. Exemplo: ar atmosférico, composto, majoritariamente, de gás oxigênio (O2) e gás nitrogênio (N2).
CLASSIFICAÇÕES DAS SOLUÇÕES
A PROPORÇÃO ENTRE SOLUTO E SOLVENTE:
- Soluções diluídas: quantidade pequena de soluto para a quantidade de solvente. Exemplo: 1 g de sal de cozinha em 1 L de água.
- Soluções concentradas: quando a quantidade de soluto é grande para a quantidade de solvente. Exemplo: 400 g de sal de cozinha em 1L de água.
Vale ressaltar que este conceito é meramente comparativo, não sendo definidas faixas onde a solução pode ser considerada diluída ou concentrada. Assim, uma solução contendo 2 g de sal em 1 L de água, pode ser considerada concentrada quando comparada a uma solução contendo 1 g em 1 L de água.
A NATUREZA DO SOLUTO
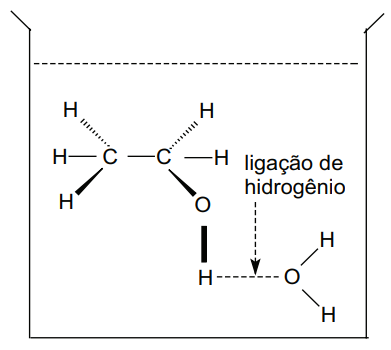
- Soluções Moleculares – são aquelas em que as partículas dispersas são moléculas, ou seja, a dissolução destas não forma íons. As moléculas são eletricamente neutras e, por isso, soluções moleculares não conduzem corrente elétrica. Exemplo: solução aquosa de etanol.
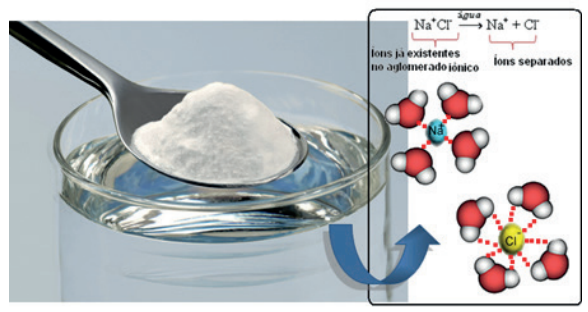
- Soluções lônicas (ou Eletrolíticas) – são aquelas em que as partículas dispersas formam íons. A presença de um campo elétrico, gerado pela diferença de potencial, gera uma corrente que permite a movimentação dos íons. Durante o processo de ionização, as moléculas de água aglomeram-se em torno dos íons, num processo conhecido por solvatação. Isto impede o reagrupamento espontâneo dos íons. Exemplo: solução aquosa de cloreto de sódio.