GASES PERFEITOS OU IDEIAIS
Alguns autores fazem distinções entre gás ideal e gás perfeito, mas alguns não. Vamos, assim como estes, tratar como sinônimos. Começaremos com as características de um gás perfeito ou ideal:
É composto de partículas puntiformes (sem dimensão).
Não há força elétrica entre as partículas (distância grande entre elas).
Há ocorrência de interação apenas durante as colisões, que são perfeitamente elásticas, ou seja, não há perda de energia após as colisões.
O estudo do comportamento dos gases resultou em uma relação entre as variáveis: temperatura (T), pressão (P), volume (V) e número de mols do gás (n). Essa relação matemática é conhecida como a Lei dos Gases Ideais (Equação de Clapeyron).
PV = nRT
Onde R é a constante dos gases perfeitos, de valor 0,082 atm⋅L/mol⋅K ou 8,31 J/mol⋅K (S.I.).
TRANSFORMAÇÕES GASOSAS (SEM ALTERAÇÃO NA QUANTIDADE DE GÁS DO RECIPIENTE)
Nota: mais para frente iremos estudar mais detalhadamente cada uma dessas transformações.
TRANSFORMAÇÃO ISOBÁRICA
É quando um gás sofre alteração no seu volume e temperatura, mas sem alterar a sua pressão.
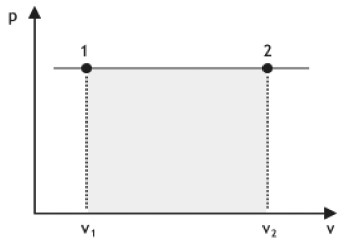
Pela equação dos gases perfeitos, podemos perceber que, se o gás vai de 1 para 2, seu volume aumenta, e como a pressão é constante, significa que a temperatura do gás aumenta. Se for de 2 para 1, a temperatura diminui.

Observação: Para realizar essa relação ou qualquer outra que seja originada da equação dos gases perfeitos, a temperatura deve estar sempre em Kelvin. Basta ver as unidades da constante R.
TRANSFORMAÇÃO ISOTÉRMICA
Pressão e volume são inversamente proporcionais. A temperatura permanece inalterada.
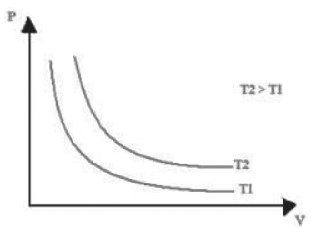
Analogamente ao caso anterior, teremos que:

Observe que:

Como toda hipérbole é escrita pela relação:

A isoterma também é uma hipérbole. Quanto maior o produto P ⋅ V, maior T, ou seja, quanto mais afastada a hipérbole está da origem, maior será a temperatura do gás durante o processo. Neste casso, T2>T1.
TRANSFORMAÇÃO ISOCÓRICA / ISOVOLUMÉTRICA / ISOMÉTRICA
Nesse caso a pressão e a temperatura são diretamente proporcionais. O volume é constante.
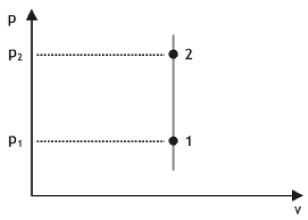
Analogamente:

Observação: Os gráficos podem ser P × T, V × T e etc. A representação P × V é a mais comum. Neste último caso, por exemplo, poderíamos ter escolhido P × T para representar a transformação:
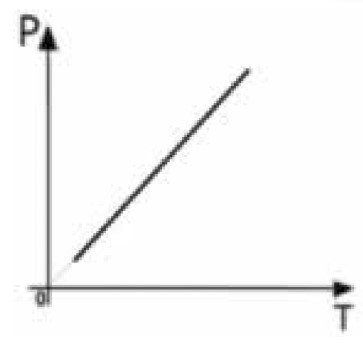
A reta nunca tocará o zero Kelvin, o domínio desta função é (0,+∞).
Exemplo 1: Certo gás está confinado em um recipiente hermeticamente fechado e inextensível. A temperatura do recipiente aumenta, aumentando a temperatura do gás em seu interior de 27 °C para 227 °C. Qual a relação entre a pressão final e inicial que o gás está submetido?
Resolução:
Como o recipiente está hermeticamente fechado, o número de mols (n) é constante.
Inextensível, ou seja, volume constante.
Então:

Perceba que transformamos °C em K.
E se houver alteração no número de mols? Vamos ver um exemplo dessa situação:
Exemplo 2: Ao abrir uma garrafa de um refrigerante, nota-se que certa quantidade de gás escapará. Vamos supor que, durante certo intervalo de tempo, 10% do gás escapou. Qual a relação entre as pressões inicial e final sofrida pelo gás? Vamos considerá-lo ideal.
Resolução:
Antes de a garrafa ser aberta:

Depois de o gás vazar:

Dividindo a 1ª pela 2ª:

Algo que naturalmente já sabíamos, após abrirmos um refrigerante, a pressão no interior da latinha reduz, se igualando à pressão externa.




