PRINCÍPIO DE LE CHATELIER
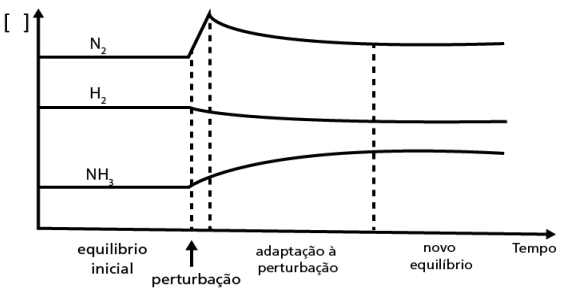
Este princípio enuncia os fatores externos que são capazes de perturbar o equilíbrio de uma reação reversível, ou seja, tornar momentaneamente as velocidades diferentes nos dois sentidos.
O sentido da reação em que a velocidade se torna maior teve a reação deslocada para tal em consequência da perturbação externa. Segundo o princípio de Le Chatelier, porém, a tendência é que a reação química se dê de maneira a reestabelecer a situação de equilíbrio.
Em outras palavras, se uma perturbação externa é aplicada a um sistema em equilíbrio, esse será alterado no sentido de reduzir o efeito da perturbação.
FATORES QUE AFETAM O EQUILÍBRIO DE UMA REAÇÃO
CONCENTRAÇÃO
Quando a concentração de uma substância no equilíbrio aumenta, a reação será deslocada no sentido do consumo dessa substância. Quando a concentração de uma substância no equilíbrio for diminuída, esse será deslocado no sentido da formação dessa substância.
Resumo:

Exemplo 1:

Se for adicionado NaC𝓁 ao sistema, haverá um aumento na concentração de C𝓁- . Assim, a reação será deslocada para a direita, provocando a alteração da coloração para azul (Efeito do íon comum).
Exemplo 2:

PRESSÃO
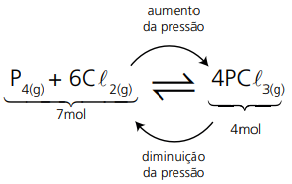
Quando a pressão total de um sistema em equilíbrio é aumentada, o volume diminui, deslocando o equilíbrio no sentido do menor volume de gases. Quando a pressão total de um sistema em equilíbrio é reduzida, o volume aumenta, deslocando o equilíbrio no sentido do maior volume de gases.
Vale frisar que a alteração na pressão total de um sistema só perturba o equilíbrio se houver pelo menos uma substância no estado gasoso.
Resumo:

Exemplo 1:

m sistemas gasosos, nas mesmas condições de temperatura e pressão, a proporção molar varia conforme a proporção volumétrica. Assim, pode-se ler o equilíbrio acima da seguinte forma, assim temos:

Se a pressão total do sistema for aumentada, o equilíbrio será deslocado no sentido do menor volume ocupado por gases (sentido dos reagentes). Assim, a concentração de N2O4 aumenta. Caso a pressão do sistema for diminuída, a reação seria deslocada no sentido do maior volume de gases (sentido dos produtos), aumentando a concentração de NO2.
Por exemplo:

Exemplo 2:
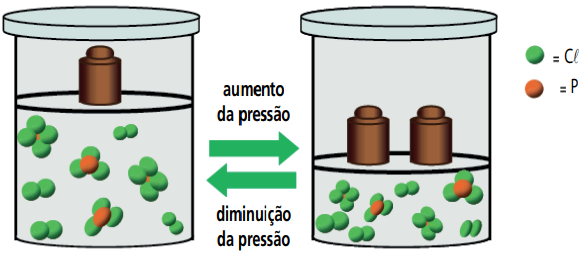
INFLUÊNCIA DA PRESSÃO PARCIAL DE UM COMPONENTE GASOSO
Num recipiente de volume constante, e numa dada temperatura, a pressão parcial de um gás é diretamente proporcional à concentração molar do mesmo. Sendo assim, o deslocamento do equilíbrio químico, provocado pela alteração da pressão parcial de um componente gasoso, é idêntico ao provocado pela alteração de sua concentração molar
TEMPERATURA
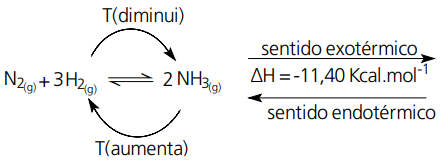
Quando a temperatura de um sistema em equilíbrio for aumentada, ele será deslocado no sentido de absorver o calor fornecido (endotérmico), onde ΔH > 0.
Se a temperatura for diminuída, o equilíbrio será deslocado no sentido de liberar calor (exotérmico), onde ΔH < 0.
Resumo:

Exemplo 1:

Observe que a reação no sentido direto é exotérmica (ΔH < 0). Sendo assim, no sentido inverso a reação é endotérmica. Se a temperatura desse sistema for aumentada, o equilíbrio será deslocado no sentido endotérmico, ou seja, dos reagentes. Se a temperatura for diminuída, o equilíbrio será deslocado no sentido direto.
Exemplo 2:
ADIÇÃO DE UM CATALISADOR
A adição de um catalisador a uma reação que já se encontra em equilíbrio não provoca qualquer deslocamento do mesmo.
Porém, é importante salientar que, se partirmos apenas de quantidades dos reagentes iniciais, o tempo para se alcançar o estado equilíbrio de uma reação é menor quando temos a adição de um catalisador.
Exemplo:

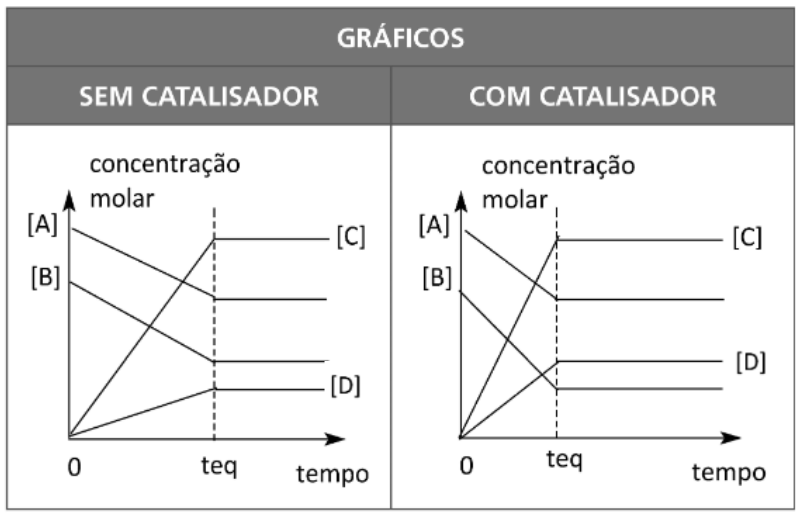
teq → tempo de equilíbrio




