Densidade Absoluta (d):

Densidade de um Gás nas C.N.T.P.:

Densidade Relativa de um Gás A em relação a um Gás B:

xemplos:
01. Determinado gás exerce pressão de 623 mmHg à temperatura de 227° C. Sua densidade vale 1,5 g/L. A massa molar desse gás, em gramas por mol, é:
Dado: R = 62,3 mmHg ⋅ L ⋅ mol-1 ⋅ K-1
a) 34
b) 75
c) 41
d) 116
e) 15
Resolução:

02. Certa massa de gás pode ser aquecida à pressão constante ou a volume constante. Pergunta-se: como irá variar a densidade do gás, respectivamente, em cada uma destas formas de aquecimento?
a) Diminui – não varia
b) Diminui – diminui
c) Não varia – aumenta
d) Aumenta – diminui
e) Aumenta – não varia
Resolução: A
À pressão constante, a densidade do gás é inversamente proporcional à temperatura, logo o aquecimento fará com que a mesma venha a diminuir. Com o volume constante, implica dizer que a densidade não irá variar, pois ela será diretamente proporcional à massa, que não varia e não depende da temperatura.
DIFUSÃO E EFUSÃO DE GASES
DIFUSÃO GASOSA
É o deslocamento de partículas de um meio em que temos uma maior concentração (quantidade por volume) de uma espécie para um meio de menor concentração. A Difusão Gasosa pode ser observada nos experimentos abaixo:
- Difusão Gasosa de um balão com gás A para outro B, inicialmente evacuado. No estado final, quando o deslocamento de partículas para, o sistema entra em equilíbrio e as pressões se igualam nos balões A e B.
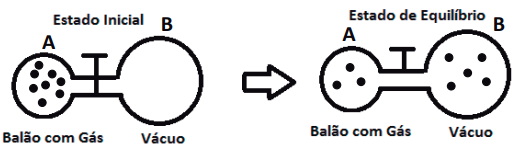
- Difusão Gasosa de um balão A preenchido com um determinado Gás, para outro B, com um diferente do anterior. Verificamos que o fenômeno efusivo ocorre tanto de A para B, como de B para A, até atingir a condição de equilíbrio, igualando a pressão final nos balões.
EFUSÃO GASOSA
A Efusão Gasosa quando a partícula do gás, ao realizar a difusão, passa por uma pequena abertura presente em seu recipiente de diâmetro desprezível.
VELOCIDADE MÉDIA DE DIFUSÃO (LEI DE GRAHAM)
Os gases quando submetidos à efusão realizam numa velocidade, v, que depende da temperatura e da sua massa molar.
RELAÇÃO COM A TEMPERATURA (T)
Do estudo da Mecânica e da Teoria Cinética dos Gases, em Física, tiramos duas valiosas equações, sobre o cálculo da Energia Cinética, EC, de uma gás, que poderão nos esclarecer sobre essa questão:
Ec = 1/2 mv2 = kT, onde m é a massa do gás, K, uma constante de proporcionalidade que depende da atomicidade da molécula do gás e T, a temperatura absoluta.
Quando um gás é aquecido de uma temperatura T1 para T2 > T1, por exemplo, a sua velocidade de difusão aumenta através da relação entre as energias cinéticas na temperatura maior, quente, e a temperatura menos, frio. Sendo assim, podemos chegar à seguinte relação:

Exemplo:
03. Uma amostra de metano apresenta a 27º C, uma velocidade de efusão igual a 100 cm/s. Determine a sua velocidade de difusão que essa amostra é aquecida à 127º C.
Resolução:

RELAÇÃO COM A MASSA MOLAR (M.M.)
Quando dois gases A e B, na mesma temperatura, submetidos ao fenômeno de difusão, o gás de menor massa molar vai escapar do seu recipiente com maior velocidade. Sendo assim, podemos chegar à seguinte relação: Sendo assim, podemos chegar à seguinte relação:

Exemplo:
Em uma experiência, para determinar a massa molar de um composto x, encontrou-se que a efusão de 25 mL do gás por uma barreira porosa leva 65 seg. A efusão do mesmo volume de argônio ocorre em 38 segundos, sob as mesmas condições. Qual a massa molar de x?
Dado massa molar em g/mol: Ar=40.
Resolução:

Como ocorre um deslocamento gasoso pelo mesmo volume, podemos dizer que vol(Ar) = vol(x), o que nos dá a relação abaixo:





