COEFICIENTE DE SOLUBILIDADE
O coeficiente de solubilidade pode ser definido como a máxima quantidade de soluto que dissolve-se em um padrão de solvente, a uma determinada temperatura.
Usualmente, o padrão utilizado é de quantidade de massa de soluto por 100g de água.
Exemplo: o coeficiente de solubilidade de uma solução de um composto A, à temperatura de 25°C, é 20g/100g de H2O. Em outras palavras, pode-se dizer que para cada 100g de H2O é possível dissolver uma quantidade máxima de 20g de A.
CURVAS DE SOLUBILIDADE
É o gráfico que apresenta a variação do coeficiente de solubilidade da substância em função da temperatura.
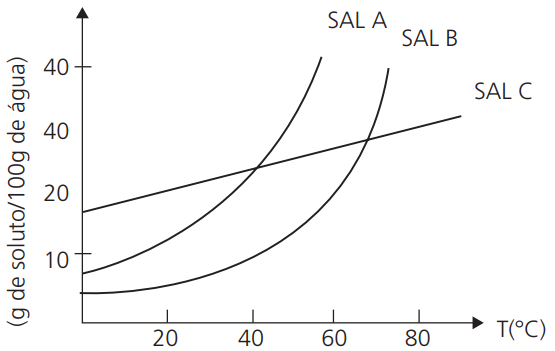
A partir da análise do grafico, pode-se obter as seguintes informações:
I. A solubilidade de um determinado sal a uma dada temperatura. Por exemplo, a 20°C, a solubilidade do sal A é, aproximadamente, de 10g/100g de H2O.
II. Comparar a solubilidade de sais em uma determinada temperatura. Por exemplo, 20°C, o sal C é o mais solúvel; já a 45°C, o mais solúvel é o sal A.
III. Como se comporta o coeficiente de solubilidade frente ao aumento ou diminuição de temperatura. Por exemplo, a solubilidade do sal A aumenta expressivamente com o aumento da temperatura.
CLASSIFICAÇÃO DAS SOLUÇÕES QUANTO À QUANTIDADE DE SOLUTO
Considere que m é igual a massa de soluto, e C.S. representa o coeficiente de solubilidade. A partir da relações entre estes, podese classificar as soluções de acordo com a quantidade de soluto presente.
SOLUÇÃO INSATURADA
Quando a massa de soluto dissolvida, a uma dada temperatura, é menor que o coeficiente de solubilidade, diz-se que a solução está insaturada.
msoluto dissolvida < C.S.
SOLUÇÃO SATURADA
Quando a quantidade de soluto dissolvido, a uma dada temperatura, é exatamente igual ao coeficiente de solubilidade.
msoluto dissolvida = C . S.
Quando a quantidade de soluto exceder o coeficiente de solubilidade, o solvente não será mais capaz de dissolver o soluto em excesso, e haverá a formação de precipitado, também chamado de corpo de fundo. Nesses casos, classifica-se essa solução como saturada com corpo de fundo.
SOLUÇÃO SUPERSATURADA
Por meio do aquecimento de uma solução saturada com corpo de fundo, dissolve-se o excesso de soluto, tornando a solução homogênea. Nesse caso, como a massa dissolvida ultrapassou o coeficiente de solubilidade, tem-se uma solução supersaturada.
msoluto dissolvida > C . S.
A solução supersaturada é instável, e qualquer perturbação ao sistema, mínima que seja, fará com que ela se torne uma solução saturada com corpo de fundo novamente.
Exemplo: considere um sal hipotético que apresenta, a 20°C, coeficiente de solubilidade igual a 10g /100g de água. Acerca desse sal, pode-se dizer que:
- Uma solução de 5g/100g de H2O → Solução insaturada
- Uma solução de 10g/100g de H2O → Solução saturada
- Uma solução de 15g/100g de H2O → Solução saturada com corpo de fundo (5g)
- Uma solução de 15g/100g de H2O a 30°C → Solução supersaturada
TIPOS DE DISSOLUÇÃO
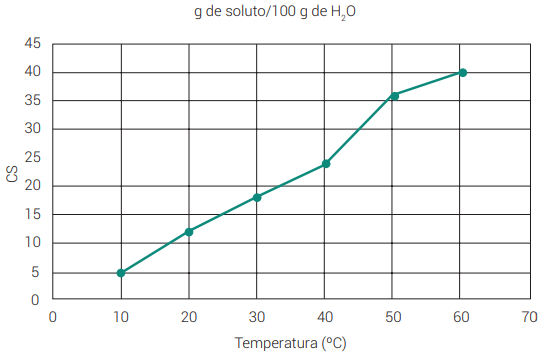
Dissolução endotérmica: aumento da solubilidade na medida em que a temperatura também aumenta. Em um gráfico, é representada por uma curva ascendente, ou seja, crescente.
Exemplo:
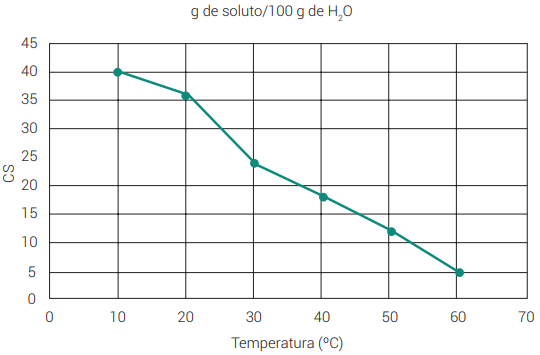
Dissolução exotérmica: diminuição da solubilidade na medida em que a temperatura aumenta. Em um gráfico, é representada por uma curva descendente, ou seja, decrescente.
A partir da curva de solubilidade, é possível determinar o tipo de solução. Quando a coordenada do gráfico estiver acima da curva, trata-se de uma solução saturada com corpo de fundo. Quando está em cima da curva, uma solução saturada. E quando a coordenada estiver abaixo do gráfico, trata-se de uma solução insaturada.
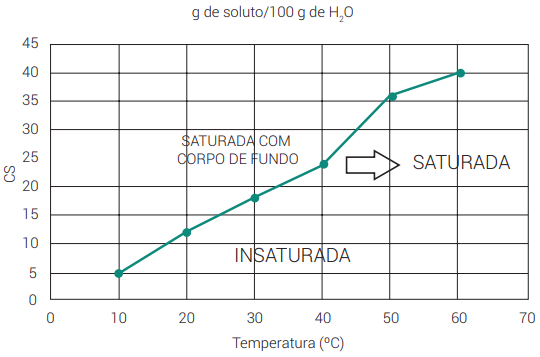
Resumo:

Exemplo:
Considere a curva de solubilidade do nitrato de potássio representada abaixo:
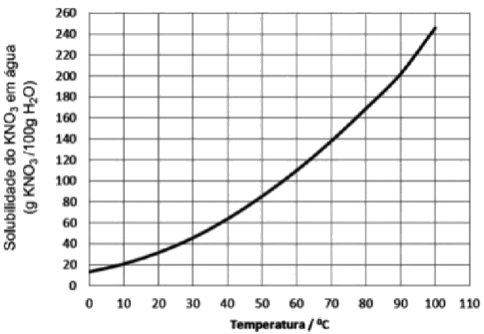
a) A 10°C, qual é a menor quantidade de água capaz de dissolver 60g de KNO3?
b) Como seria classificada uma mistura que foi preparada com 7g de KNO3 e 10g de água a 70°C?
c) Numa temperatura constante, T, evaporou-se totalmente a água de 30g de uma solução saturada obtendo-se 20g de resíduo sólido. Qual é o valor da temperatura T?
d) Resfriou-se 6kg de solução saturada, sob constante agitação, de 90°C para 10°C.
Resolução:
a) Observando o gráfico a 10°C, verificamos que o coeficiente de solubilidade do KNO3 é igual 20g de KNO3 por 100g de água. Logo, podemos escrever:
20 g de KNO3 → 100 g de H2O
60 g de KNO3 → x
x =(60)(100)/20 = 300 g
b) Observando o gráfico a 70°C, verificamos que o coeficiente de solubilidade do KNO3 é igual 140g de KNO3 por 100g de água. Logo, podemos escrever:
140 g de KNO3 → 100 g de H2O
x → 10 g de H2O
x = (140)(10)/100 =14 g→ um sistema unifásico pois 7g é uma massa inferior aos 14g de KNO3 necessários para saturar a solução.
c) O processo de evaporação total da solução saturada nos leva a concluir que a massa inicial de 30g de solução está distribuída com 20g de resíduo sólido e 10g de água. Logo, podemos realizar o seguinte raciocínio:
20 g de KNO3→10 g de H2O
x→100 g de H2O
x = (20)(100)/10 = 200 g → Encontramos a temperatura através da consulta ao gráfico. Concluímos, então, que a temperatura correspondente a 200g de KNO3 é 90°C.
d) Observando o gráfico, percebemos que o resfriamento de uma solução de 90°C para 10°C implicaria numa redução da massa de solução de 300 g (200 g de KNO3 + 100 g de H2O) para 120 g (20 g de KNO3 + 100 g de H2O).
Esse procedimento, sob intensa agitação, nos daria uma massa de precipitado de 80 g de KNO3 (200-120). Desta forma, é possível executar o seguinte raciocínio:
80 g de precipitado →300 g de solução saturada
x → 6000 g de solução saturada
x = (80)(6000)/300 = 1600g = 1,6 Kg




