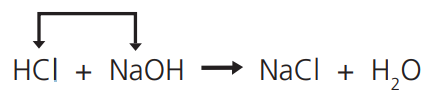QUANTO À LIBERAÇÃO OU ABSORÇÃO DE CALOR
REAÇÃO EXOTÉRMICA
São as reações que liberam calor.
Exemplo:

REAÇÃO ENDOTÉRMICA
São as reações que absorvem calor.
Exemplo:

UANTO À REVERSIBILIDADE
REAÇÕES REVERSÍVEIS
Ocorrem nos dois sentidos (o que é indicado por duas flechas).
H2 + I2 ⇄ 2HI
Neste exemplo, isto só acontece quando as substâncias estão no estado gasoso e aquecida a 450 °C.
REAÇÕES IRREVERSÍVEIS
Ocorrem apenas em um sentido:
C + O2 ⟶ CO2
É o caso da queima do carvão.
QUANTO À VARIAÇÃO DO NOX DOS ELEMENTOS
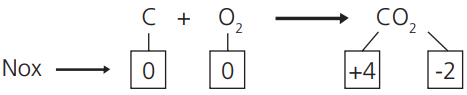
REAÇÕES DE OXIRREDUÇÃO
Quando há variação do NOX de um ou mais elementos:
REAÇÕES SEM OXIRREDUÇÃO
Quando não há variação do NOX de nenhum elemento envolvido:
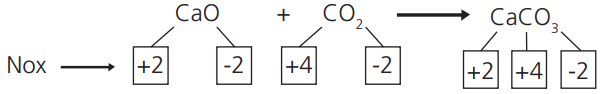
QUANTO AO TIPO DAS SUBSTÂNCIAS ENVOLVIDAS
REAÇÕES DE SÍNTESE OU ADIÇÃO
Quando duas ou mais substâncias reagem, produzindo uma única substância mais complexa:

Observação:
- Símbolos: ↑ formação de gás; ↓ formação de precipitado
Basta “pôr fogo” no enxofre sólido; mas cuidado, pois o SO2 é um gás muito tóxico.
CaO + H2O → Ca(OH)2
CaO é “cal virgem”, comprada em lojas de material de construção. O produto Ca(OH)2 é a “cal hidratada” ou “cal extinta”.
Observação:
A reação de síntese pode ser dividida em:
- Síntese total: quando partimos apenas das substâncias simples (1º e 2º exemplos anteriores).
- Síntese parcial: quando, dentre os reagentes, já houver no mínimo uma substância composta (3º exemplo anterior).
REAÇÕES DE ANÁLISE OU DECOMPOSIÇÃO
Quando uma substância se divide em duas ou mais substâncias de estruturas mais simples:

Cuidado: reação explosiva! Misture KC𝓁O3 em pó e MnO2 em pó e aqueça com cuidado; o MnO2 modera a reação.

Aqueça o Cu(NO3)2 sólido.
Observação:
Certas reações de análise ou de decomposição recebem nomes especiais como:
PIRÓLISE: decomposição pela luz.
ELETRÓLISE: decomposição pela eletricidade.
FOTÓLISE: decomposição pela luz.
IMPORTANTE: Alguns autores consideram que há uma diferença entre reação de decomposição e reação de análise.
DECOMPOSIÇÃO: pode formar no produto tanto substâncias simples como compostas.
ANÁLISE: não pode formar substância composta, só ocorre a produção de substâncias simples. Toda a reação de análise é de decomposição, mas a recíproca não é verdadeira.
REAÇÕES DE DESLOCAMENTO OU DE SIMPLES TROCA
Quando uma substância simples reage com uma substância composta e “desloca”, desta última, uma nova substância simples:
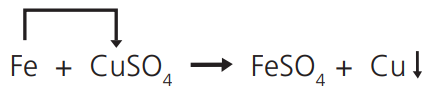
Mergulhe um prego (ferro) numa solução de CuSO4, retire o prego após alguns minutos; ele estará avermelhado – é uma camada de cobre.
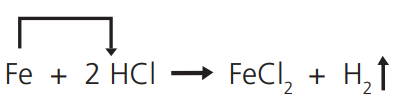
Mergulhe um prego (ferro) num pouco de ácido muriático (HC𝓁) diluído em água; verifique a saída de bolhas de hidrogênio.
REAÇÕES DE DUPLA TROCA OU DE PERMUTAÇÃO
Quando dois compostos reagem, permutando entre si dois elementos ou radicais e dando origem a dois novos compostos:
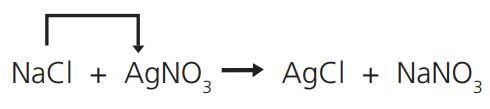
Num tubo de ensaio, dissolva NaC𝓁 em água; em outro tubo, dissolva AgNO3 em água; junte as duas soluções e observe o precipitado branco do AgC𝓁.
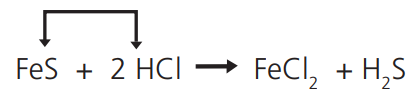
Ao FeS sólido, junte ácido muriático (HC𝓁) e sinta cheiro de “ovos podres” do gás H2S que se libera.
A própria reação de salificação ou neutralização (ácido + base) é um exemplo de reação da dupla troca: