Além do contato e afinidade, também é necessária uma orientação favorável na colisão entre as moléculas de reagente, e uma determinada energia, chamada energia de ativação, deve ser atingida para que a reação de fato ocorra, o que se inicia após a formação do complexo ativado.
Complexo ativado: estado intermediário formado entre os reagentes e os produtos. É um momento onde as ligações dos reagentes estão sendo enfraquecidas e as dos produtos sendo formadas.
Energia de ativação: é a energia mínima necessária para que a reação inicie, ou seja, para que se inicie a formação do complexo ativado.
VELOCIDADE MÉDIA (VM) ESPECÍFICA DE UM COMPONENTE DA REAÇÃO QUÍMICA
É definida como a variação da quantidade (ΔQ) de um componente da reação (massa, número de mols, volume, número de partículas, concentração molar) pela variação, intervalo de tempo em que ocorreu essa variação (Dt).

Observação: A forma mais comum de expressar a velocidade média de uma reação é em função da variação da concentração molar do componente. Desta forma, expressamos a mesma em unidades como mol ⋅ L-1 ⋅ s-1, mol ⋅ L-1 · min-1, por exemplo.
VELOCIDADE MÉDIA DE UMA REAÇÃO
Devemos levar em conta os seguintes fatores:
- Apresenta um único valor;
- Seu valor é positivo;
- Deve-se levar em conta a proporção molar estequiométrica entre os componentes da reação;
- Os reagentes apresentam velocidades médias específicas negativas (DQ<0);
- Os produtos apresentam velocidades médias específicas positivas (DQ>0).
Cálculo da Velocidade Média de uma Reação Química, levando-se em conta a variação da concentração molar de cada um de seus componentes.

Exemplos:
01. A tabela abaixo apresenta a variação da concentração molar do gás ozônio (O3) na reação:
2O3(g) → 3O2g
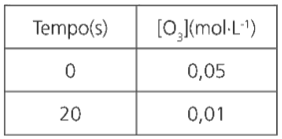
Determine em mol ⋅ L-1 ⋅ s-1:
a) A velocidade média de consumo do O3.
b) A velocidade de produção do O2.
c) A velocidade média da reação.
Resolução:

02. A combustão completa do gás butano se dá num bico de combustão numa velocidade de consumo do gás igual a 20 mol por minuto.
a) Determine, nas C.N.T.P., o volume, em litros, de dióxido de carbono que pode ser obtido após 2 horas de funcionamento contínuo do bico.
b) Quanto tempo, em minutos, é necessário para a produção de 8960 L de dióxido de carbono nas C.N.T.P?
Resolução:
a)

Consumo de C4H10 = (20 mol/min)(2)(60 min) = 2400 mol.
Volume de CO2 produzido = (2400 mol)(4)(22,4 L/mol) = 215040 L.
b)
4(22,4)L de CO2 → 1 min
8960L de CO2 → t
t = 100 min




