REAÇÕES QUÍMICAS ELEMENTARES
São reações que se processam numa única etapa. Para essas reações, a ordem de cada reagente é dada pelo coeficiente estequiométrico inteiro da equação química devidamente balanceada.
Para a reação química elementar: (x)A + (y)B →(z)C +(w)D
Teremos a Lei de Velocidade: V =K[A]x × [B]y
Exemplo:
Uma reação elementar genérica é representada pela equação abaixo:
2A(g) + 3B(g) → A2B3(g)
O que ocorrerá com a velocidade da reação se duplicarmos as concentrações molares dos reagentes sem alterarmos as demais constantes físicas?
Resolução:
v = K[A]2[B]3
Estado inicial: v(inicial) = K(x)2(y)3
Estado final: v(final) = K(2x)2(2y)3 = K(4x2)(8y3) = 24k(x)2(y)3 → Aumenta 24 vezes.
REAÇÕES QUÍMICAS NÃO ELEMENTARES (MECANISMO DE UMA REAÇÃO QUÍMICA)
São reações que se processam em duas ou mais etapas elementares. Para essas reações, a Lei de Velocidade é dada pela Lei de Velocidade da etapa mais lenta.
Exemplo:
A reação: N2(g) + O2(g) → 2NO2(g), ocorre segundo a soma das etapas:
Etapa I: N2(g) + O2(g) → 2NO(g)
Etapa II: 2NO(g) + O2(g) → 2NO2(g)
Abaixo, está representado o diagrama de energia da reação:
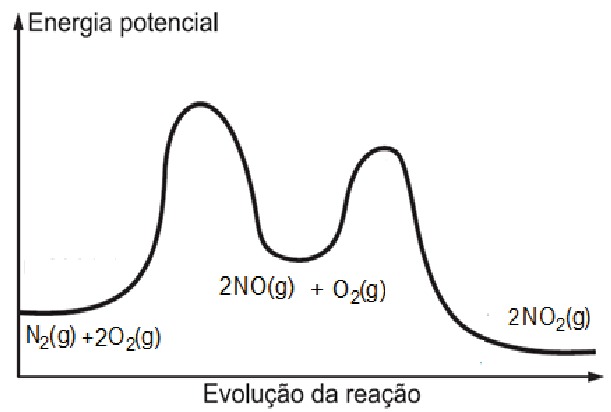
Escreva a expressão matemática da lei de velocidade da reação global.
Resolução:
v = K [Produto das concentrações dos reagentes da etapa lenta] = K[N2][O2]
ESTUDO CINÉTICO DE UMA REAÇÃO
Mostra a variação da velocidade de uma reação em função das alterações ocorridas com as concentrações molares dos reagentes.
Algumas ordens de reações frequentes:
Ordem zero → A velocidade da reação se mantém constante com a variação da concentração do reagente.
Primeira ordem → A velocidade da reação varia na mesma proporção da variação da concentração do reagente.
Segunda ordem → A velocidade da reação varia ao quadrado da variação da concentração do reagente.
Exemplo:
A temperatura fez-se a seguinte reação:
2H2(g) + 2NO(g) → N2(g) + H2O(ℓ)
Mediram-se valores de concentração molar dos reagentes e a velocidade obtida em cada experimento, obtendo-se os resultados abaixo:
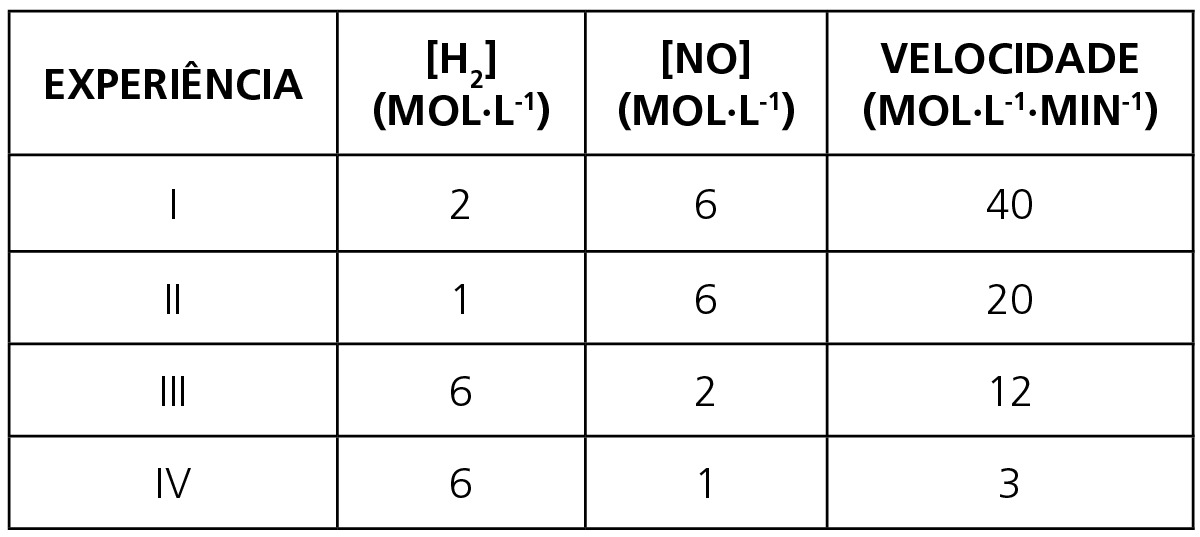
Determine:
a) A ordem global da reação.
b) O valor da constante cinética da reação.
Resolução:
a) Observando as experiências II e I, nessa ordem, percebemos que para uma concentração de NO constante, a variação de H2 dobra de valor e a velocidade da reação também dobra. Logo, a reação química é de primeira ordem em relação à concentração de H2. Observando as experiências IV e III, nessa ordem, percebemos que para uma concentração de H2 constante, a variação de NO dobra de valor e a velocidade da reação quadruplica. Logo, a reação química é de segunda ordem em relação à concentração de NO. Podemos, então, concluir que a reação é de terceira ordem.
b) V = K[H2][NO]2 → substituído na experiência I → (40 mol ⋅ L-1 ⋅ min-1) = K(2 mol ⋅ L-1)(6 mol ⋅ L-1)2 → (40 mol ⋅ L-1 ⋅ min-1) = 72 K(mol3 ⋅ L-3) → K = 0,56.




