TEORIA DAS COLISÕES EFETIVAS
Para que ocorra uma reação química, algumas condições são necessárias:
I. Os reagentes devem estar em contato;
II. Deve haver afinidade química entre os reagentes;
III. A colisão entre as moléculas dos reagentes deve obedecer a uma orientação espacial ideal.
Exemplo:
Considere a representação da reação H2(g) + Cℓ2(g) → 2HCℓ(g).
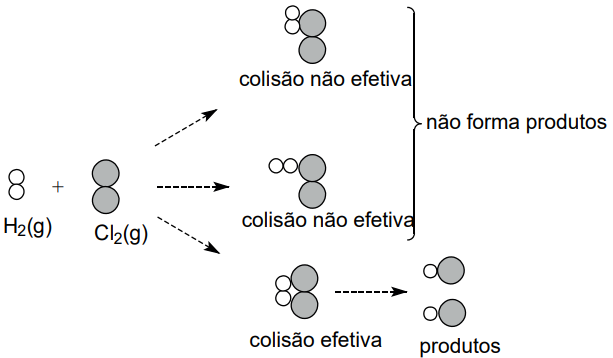
INFLUÊNCIA DO ESTADO DE AGREGAÇÃO DOS REAGENTES
Quanto maior for o número de ligações a serem rompidos nos reagentes e quanto mais fortes forem essas ligações, mais lenta será a reação e vice-versa.
- De um modo geral, as reações que têm substâncias orgânicas como reagentes são mais lentas se comparadas com as substâncias inorgânicas. Esse fato pode ser justificado pela grande quantidade de ligações químicas que precisam ser rompidas numa substância orgânica.
- Uma reação em que todos os reagentes são gases é sempre mais rápida do que a mesma reação com todos os reagentes líquidos ou sólidos. Esse fato pode ser justificado pela grande quantidade de ligações químicas intermoleculares que precisam ser rompidas no estado líquido e sólido.
- Uma reação em que foi possível transformar os reagentes em íons é mais rápida do que a mesma reação com os reagentes no seu estado físico original. Esse fato pode ser justificado pela ação do solvente ionizante que rompe prematuramente as ligações químicas.
Exemplo:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(ℓ) (muito lenta a 20°C)
HCℓ(aq) + NaOH(aq) → NaCℓ(aq) + H2O(0) (instantânea a 20°C)
INFLUÊNCIA DA SUPERFÍCIE DE CONTATO ENTRE REAGENTES
Quanto maior a superfície de contato dos reagentes envolvidos, maior a velocidade da reação e vice-versa.
Exemplo:
Quando mergulhamos um pequeno pedaço de alumínio metálico numa solução de ácido sulfúrico, é possível observar uma reação representada pela equação química abaixo:
2Aℓ(s) + 3H2SO4(aq) → Aℓ2(SO4)3 + 3H2(g)
O uso do alumínio na forma de raspas no lugar de uma barra torna a reação consideravelmente mais rápida à mesma temperatura, pressão e concentração molar da solução de ácido sulfúrico. Esse fato pode ser justificado pela maior superfície de contato entre o alumínio em raspas e a solução de ácido sulfúrico.
INFLUÊNCIA DA LUZ E ELETRICIDADE
Luz – As chamadas reações fotoquímicas são reações que aumentam significativamente a sua velocidade na presença da luz.
Exemplo:
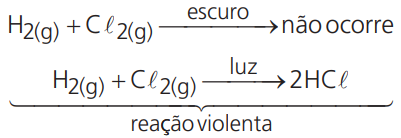
Eletricidade – Da mesma forma, outras reações são estimuladas pela ação da eletricidade.
Exemplo:
A síntese total da água na ausência da eletricidade é extremamente lenta. Na presença de uma centelha elétrica, é espontânea.
INFLUÊNCIA DA PRESSÃO
Para reações que se processam em fase gasosa, o aumento da pressão, numa dada temperatura, provoca um aumento da velocidade da reação. Esse fato é explicado pela diminuição do volume total que consequentemente diminui a distância entre as moléculas dos reagentes e, desta forma, aumenta a probabilidade de colisões efetivas entre elas.
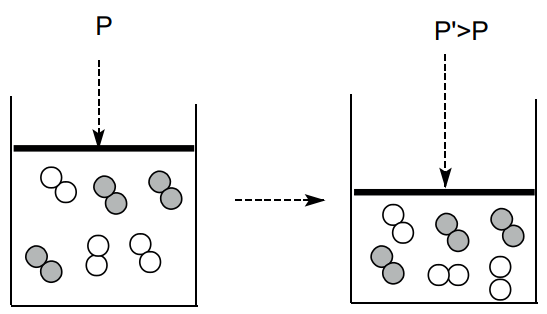
INFLUÊNCIA DA TEMPERATURA
O aumento da temperatura aumenta a velocidade das reações químicas. Esse fato é explicado pelo aumento da energia cinética média das moléculas dos reagentes que aumenta a probabilidade de ocorrência de colisões efetivas.
As reações endotérmicas são as que apresentam um maior aumento de sua velocidade com o aumento da temperatura.
Gráfico da distribuição energética das partículas (Distribuição de Maxwell e Boltzman):
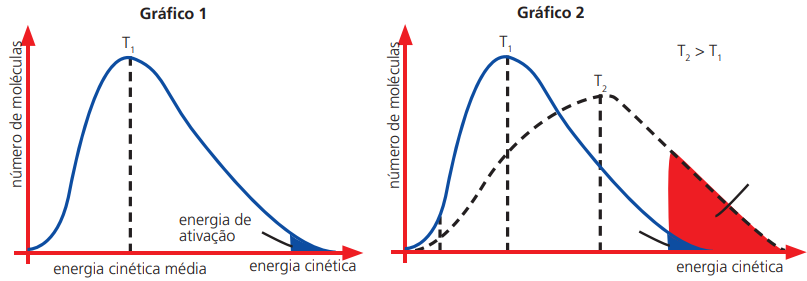
O aumento da temperatura de T1 para T2 aumentou a área sob a curva.
Isso significa que houve um aumento do número de moléculas no valor da energia de ativação da reação.
CATALISADORES E INIBIDORES
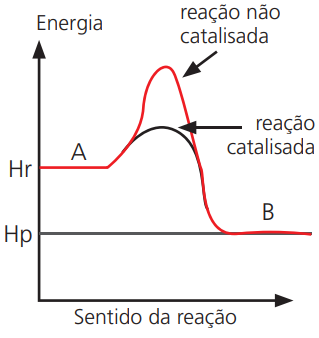
Catalisadores – São substâncias que, quando adicionados aos reagentes, aceleram a reação química sem participar quimicamente da sua etapa global, ou seja, não é consumido, regenerando-se completamente no final da reação. O catalisador acelera a reação pois diminui a energia de ativação da mesma. O catalisador não altera o valor de ΔH da reação e nem altera o rendimento da mesma.
Catálise Homogênea – O catalisador se encontra no mesmo estado físico dos reagentes. Nesse tipo de catálise, a reação se processa em mais de uma etapa de forma que a espécie catalisadora é consumida numa etapa e produzida numa etapa seguinte:
Exemplo:
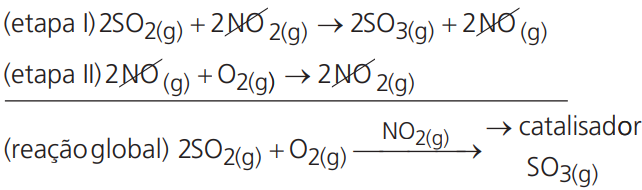
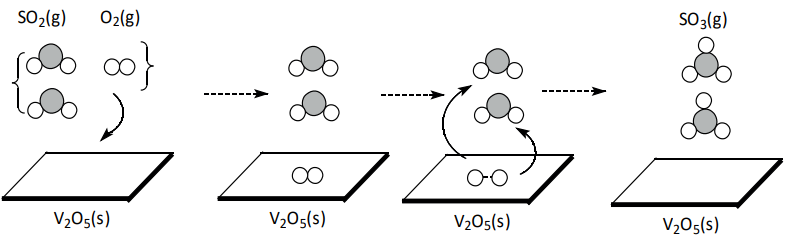
Catálise Heterogênea – O catalisador num estado físico diferente dos reagentes. Nesse tipo de catálise, o catalisador, geralmente sólido, oferece uma superfície de adsorção que “prende” um dos reagentes, enfraquecendo suas ligações, e facilita o acesso do outro reagente:
Exemplo:
Energeticamente, os catalisadores aumentam a velocidade das reações porque diminuem a energia de ativação da mesma.
Autocatálise – É quando um dos produtos da reação atua também como catalisador da mesma:
3Cu(s) + 8NHO3(aq) → 3Cu(NO3)2(aq) + 4H2O(ℓ) + 2NO2(g)
Inibidores – Tem ação inversa dos catalizadores. Um bom exemplo do fenômeno de inibição ocorre nos processos bioquímicos quando uma determinada substância reage paralelamente com um dos reagentes da reação, comprometendo sua velocidade.




