CALOR
Podemos citar um procedimento que era feito para esfriar um copo de café ou de leite quando acabava de ficar pronto e se encontrava muito quente. Colocava-se café em um copo assim que o café havia acabado de ficar pronto. Para esfriar mais rápido e estar logo pronto para beber colocava-se um pouco de água a temperatura ambiente (ou gelada) numa vasilha e colocava-se o copo de café muito quente dentro dessa vasilha com água. Durante um tempo a temperatura do copo de café abaixava enquanto o da água na vasilha aumentava até que ambas as temperaturas se igualavam. Fenômenos como este acontecem sempre que colocamos um corpo quente em presença de um corpo mais frio. De alguma forma o corpo quente atua sobre o corpo mais frio, exclusivamente pela diferença de temperatura. Este fenômeno interpretamos como uma fonte de energia chamada calor.
A transferência de calor se dá até o momento que ambos os corpos chegam a mesma temperatura e atingem o que chamamos de equilíbrio térmico.
À medida que o corpo quente cede calor sua temperatura diminui e à medida que o corpo frio recebe calor sua temperatura aumenta.
ENERGIA TÉRMICA E DIFERENÇA DE TEMPERATURA
ENERGIA TÉRMICA
A energia térmica é a energia que está diretamente ligada a temperatura de um corpo. A energia térmica está diretamente ligada com o movimento e agitação das moléculas e átomos do sistema. Aumentando-se a temperatura aumentamos essa agitação e consequentemente aumentamos a energia térmica e quando diminuímos a temperatura temos o processo inverso.
A energia relacionada com a temperatura de um corpo é a energia térmica enquanto calor é a energia transferida de um corpo para outro.
DIFERENÇA DE TEMPERATURA
Se há diferença de temperatura entre dois corpos, por exemplo, há a transferência de energia na forma de calor, cessada essa diferença não há mais troca de calor. Não relação entre energia térmica e a troca de calor entre dois corpos.
UNIDADE DA QUANTIDADE DE CALOR
Por ser uma forma de energia, pelo SI, o calor é medido em joule (J), mas por razões históricas o calor é medido em caloria (cal) que foi assim definido.
Uma caloria (cal) é a quantidade de calor necessária para aquecer 1 grama de água de 14,5 °C para 15,5 °C, sob pressão normal.
Temos também a quilocaloria (kcal): 1 kcal = 1000 cal
Uma quilocaloria (kcal) é a quantidade de calor necessária para aquecer 1 quilograma de água de 14,5 °C para 15,5 °C, sob pressão normal.
Temos a relação
1cal = 4,186 J ⇒ 1cal ≅ 4,2 J
AQUECIMENTO DE UM CORPO
Vamos imaginar que iremos aquecer uma massa de água, inicialmente congelada, dessa forma iremos aquecer inicialmente uma massa de gelo até evaporarmos todo esse gelo.
Vamos imaginar que nosso gelo se encontra a -10 ºC e todo o processo se dará a pressão normal (nível do mar) e que vamos aquecer de forma constante a massa de gelo.
De forma gradativa a temperatura irá subir até 0 ºC, que é a temperatura de fusão do gelo, mas até que toda a massa de gelo derreta e mude para o estado líquido a temperatura não irá se alterar, se mantendo assim em 0 ºC. Após todo o gelo ser derretido novamente a temperatura, agora de água líquida, irá aumentar até atingir 100 ºC, onde irá a temperatura se manter constante até que toda a massa de água seja evaporada.
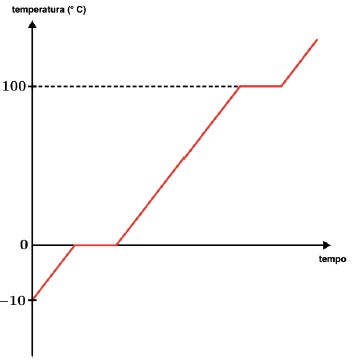
Podemos generalizar para qualquer substância.
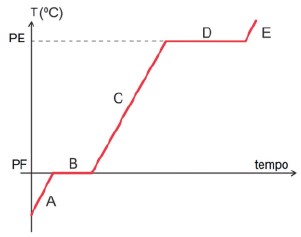
Curva de aquecimento de uma substância.
- A: Aquecimento na fase sólida, desde a temperatura inicial até seu ponto de fusão (PF).
- B: Fusão da substância, que ocorre com a temperatura constante no ponto de fusão (PF).
- C: Aquecimento na fase líquida, do ponto de fusão (PF) até o ponto de ebulição (PE).
- D: Vaporização da substância, ocorre com a temperatura constante no ponto de ebulição (PE).
- E: Aquecimento na fase gasosa, do ponto de vaporização ou ebulição (PE) até uma temperatura final.
CAPACIDADE TÉRMICA
Devido ao aquecimento a temperatura do corpo sofrerá uma variação dada por:
ΔT = Tf – TI
A capacidade térmica é a razão entre a quantidade de calor (Q) recebida por um corpo e sua variação de temperatura (∆T). Observe que ela também pode ser calculada pelo produto da massa (m) pelo calor específico (c).

Unidade da capacidade térmica: cal/ºC ou J/K.
CALOR ESPECÍFICO
Experimentalmente se verifica que a capacidade térmica de um corpo é proporcional à sua massa.
C = c · m
Nessa equação, c é uma constante denominada calor específico do material. O calor específico é uma propriedade do material que constitui o corpo. Sendo assim

A definição original de caloria e a equação c = Q/m.ΔT nos levam ao calor específico da água:

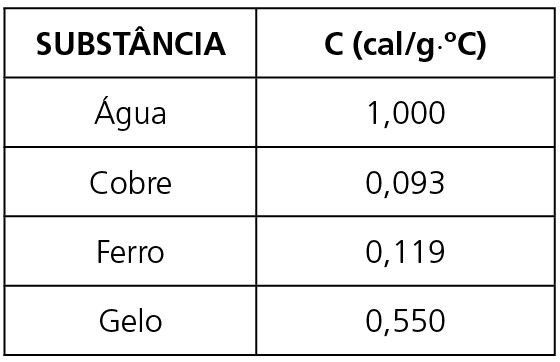
Observe na tabela abaixo alguns calores específicos das substâncias.
QUANTIDADE DE CALOR SENSÍVEL
Da equação C = c ⋅ m teremos:

Quando o corpo sofrer variação de temperatura, ou seja, variar a energia cinética das suas partículas, dizemos que ele recebeu um calor sensível. Podemos quantificar a quantidade de energia pela Equação Fundamental da Calorimetria.
Q = m · c · ΔT
Em que:
- Q é quantidade de calor sensível
- c é o calor específico da substância, que depende da natureza do material e possui unidade de medida cal/g ºC ou J/kg ⋅ K
- m é massa do corpo
- ∆T é variação de temperatura
EQUIVALENTE EM ÁGUA
O equivalente em água de um corpo é definido como a massa de água que possui a mesma capacidade térmica daquele corpo. Ou seja, com uma mesma quantidade de calor, sofre a mesma variação de temperatura que o corpo. Essa comparação com a água é muito útil em laboratório, pois o calor específico da água vale Cágua = 1,0 cal/g·C∘.
Assim, podemos descrever o equivalente matematicamente como:
Ccorpo = Cágua ⇒ (m · c)corpo = (m · c)água (m · c)corpo = mágua
CALOR LATENTE
Quando o corpo sofrer mudança de estado físico, ou seja, variar a energia potencial das suas partículas, dizemos que ele recebeu um calor latente. Podemos quantificar a quantidade de energia através da equação:
Q =m · L
em que:
- Q é quantidade de calor sensível
- L é o calor específico da substância, que depende da natureza do material e possui unidade de medida cal/g ou J/kg
- m é massa do corpo
- ∆T é variação de temperatura
TROCAS DE CALOR E EQUILÍBRIO TÉRMICO
Já falamos anteriormente que corpos diferentes temperaturas em um sistema isolado trocam calor até alcançarem o equilíbrio térmico. Vamos considerar que não há perdas energéticas, assim os calores trocados pelos corpos têm que ser nulos:
∑Qtrocados = 0 ⇒ Qrecebldo + Qcedldo = 0
O calor é positivo, Q > 0 quando o corpo ganha calor.
O calor é negativo, Q < 0 quando o corpo perde calor.




