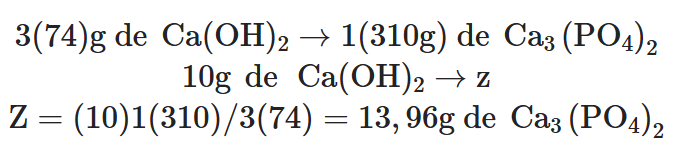Devemos levar em consideração os seguintes conceitos:
Reagente Limitante → Sua quantidade é totalmente consumida pela reação.
Reagente Excedente → Apenas parte de sua quantidade é consumida pela reação.
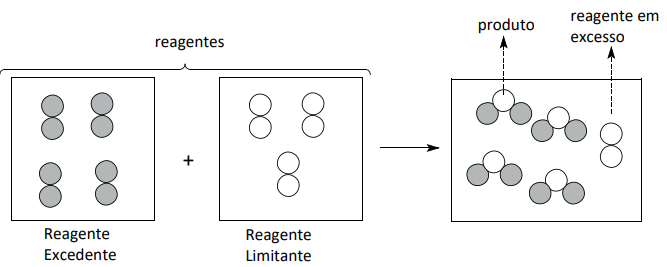
Nesse caso, devemos levantar uma hipótese que aponta o reagente limitante e o reagente excedente.
Confirmada a hipótese, damos continuidade aos cálculos.
Não confirmando a hipótese, devemos efetuar os cálculos invertendo a hipótese anterior.
Observação: Para se calcular a quantidade dos produtos, é aconselhável usar a quantidade do reagente limitante como base de cálculo.
Exemplo:
01. Foram misturados num recipiente, 9,8 g de ácido fosfórico, H3PO4, com 10 g de hidróxido de cálcio, Ca(OH)2.
a) Identifique os reagentes limitante e excedente, se houver.
b) Determine se houver a massa do reagente excedente.
c) Determine a maior massa de fosfato de cálcio, Ca3(PO4)2 que pode ser obtida nessa reação.
Dado: massas molares em g⋅mol–1 H3PO4 = 98; Ca(OH)2 = 74; Ca3(PO4)2 = 310.
Resolução:
Escrevendo a equação química: H3PO4 + Ca(OH)2 → Ca3(PO4)2 + H2O
Equação química balanceada: 2H3PO4 + 3Ca(OH)2 → Ca3(PO4)2 + 6H2O
Proporção molar entre as substâncias envolvidas no problema: 2 mol de H3PO4 → 3 mol de 3Ca(OH)2 → 1 mol de Ca3(PO4)2
Observação:
Proporção entre as massas das substâncias envolvidas no problema:
2(98 g) de H3PO4 →3(74)g de Ca(OH)2 →1(310 g) de Ca3(PO4)2
HIPÓTESE: o ácido fosfórico é o reagente limitante.
2 mol de 3PO4 → 3 mol de 3Ca(OH)2 → 1 mol de Ca3(PO4)2
Observação:
Proporção entre as massas das substâncias envolvidas no problema:
2(98g) de H3PO4 → 3(74)g de Ca(OH)2 → 1(310g) de Ca3(PO4)2
HIPÓTESE: o ácido fosfórico é o reagente limitante.
Verificação:

Esse resultado nos mostra que o que se tem de hidróxido de cálcio, 10 g, é menor que o previsto. Logo, a hipótese está errada.
HIPÓTESE CORRETA: o hidróxido de cálcio é o reagente limitante:
Verificação:
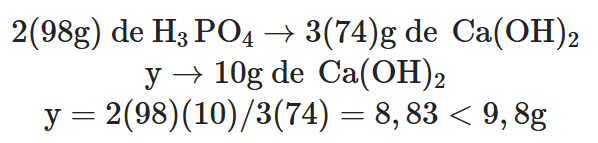
Esse resultado nos mostra que o hidróxido de cálcio é o reagente limitante.
Reagente Limitante → hidróxido de cálcio.
Reagente excedente → ácido fosfórico.
Massa de excedente = 9,8 – 8, 83 = 0,97g de H3PO4