PROBLEMAS ENVOLVENDO QUANTIDADES DE MATÉRIA (MOL, MASSA E NÚMERO DE PARTÍCULAS) DE SUBSTÂNCIAS PURAS E COM RENDIMENTO IGUAL A 100%
Relação fundamental para resolução de problemas:
1 mol de uma substância → massa molar(g) → 6,0×1023 moléculas.
Exemplo:
01. Qual é a massa de ácido sulfúrico (H2SO4) necessária para consumir totalmente 4,0 g de hidróxido de sódio (NaOH) numa reação de neutralização total?
Dados: massas molares em g⋅mol-1, NaOH = 40, H2SO4 = 98.
Resolução:
Escrevendo a equação química: H2SO4 + NaOH → Na2SO4 + H2O
Equação química balanceada: H2SO4 + 2NaOH → Na2SO4 + 2H2O
Proporção molar entre as substâncias envolvidas no problema: 1 mol de 2SO4 → 2mol de NaOH.
Proporção entre as massas das substâncias envolvidas no problema: 98g de H2SO4 → 2(40)g de NaOH
Efetuando os cálculos:
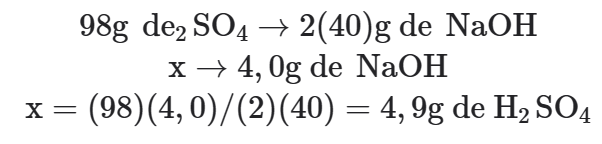
PROBLEMAS ENVOLVENDO VOLUMES DE SUBSTÂNCIAS GASOSAS QUE SE ENCONTRAM NAS C.N.T.P
Relação fundamental para resolução de problemas com substâncias gasosas nas C.N.T.P.:
1 mol de uma substância gasosa nas C.N.T.P. → massa molar(g) → 22.4 Litros.
02. Qual é o volume, nas C.N.T.P. de dióxido de carbono (CO2) obtido na combustão completa de 9,2 g de etanol (C2H6O)? Dados: massa molar do etanol em g ⋅ mol–1 = 46.
Resolução:
Escrevendo a equação química: C2H6O + O2 → CO2 + H2O
Equação química balanceada: C2H6O + 3O2 → 2CO2 + 3H2O
Proporção molar entre as substâncias envolvidas no problema: 1mol de C2H6O → 2mol de CO2.
Proporção entre as quantidades das substâncias envolvidas no problema: 46g de C2H6O → 2(22,4)L de CO2
Efetuando os cálculos:
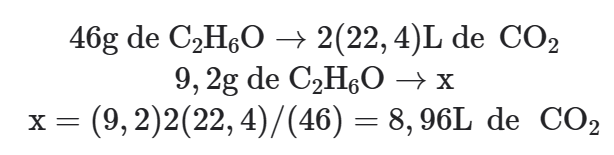
PROBLEMAS ENVOLVENDO VOLUMES DE SUBSTÂNCIAS GASOSAS QUE NÃO SE ENCONTRAM NAS C.N.T.P.
Quando as substâncias gasosas não se encontram nas C.N.T.P., é mais aconselhável não converter o seu número de mols para depois aplicar a Equação de Clapeyron, PV = nRT.
03. Qual é a massa de alumínio metálico que será totalmente dissolvida numa solução aquosa de ácido sulfúrico (H2SO4) de forma que se possa produzir a 2 atm e 127 ºC, 41 L de gás hidrogênio (H2)?
Dados: massa molar em g · mol–1: Aℓ = 27; constante universal dos gases = 0,082 atm ⋅ L ⋅ mol-1 ⋅ K-1.
Resolução:
Escrevendo a equação química: Aℓ + H2SO4 → Al2(SO4)3 + H2.
Equação química balanceada: Aℓ + 3H2SO4 → Al2(SO4)3 + 3H2.
Proporção molar entre as substâncias envolvidas no problema: 1 mol de Aℓ → 3mol de H2
Proporção entre as quantidades das substâncias envolvidas no problema: 27g de Aℓ → 3mol de H2
Calculando o número de mols de H2:

Efetuando o cálculo da massa de alumínio:
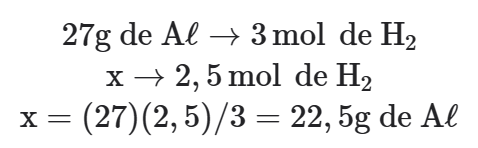
PROBLEMAS ENVOLVENDO RENDIMENTO INFERIOR A 100%
Numa reação química, nem sempre ocorre a total conversão dos reagentes nos produtos desejados. É possível a ocorrência de uma reação com formação de um produto indesejável.

Cada quantidade de reagente que se converte em produtos indesejáveis, provoca uma queda percentual de rendimento da reação.
Devemos levar em conta as seguintes quantidades:
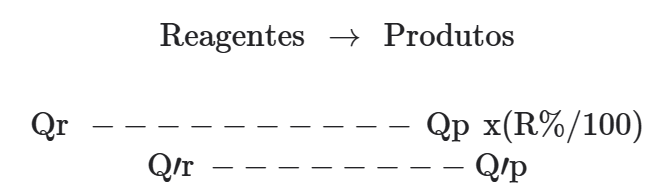
Qr → quantidade proporcional do reagente considerado.
Qp → quantidade proporcional do produto num rendimento de 100%.
R(%) → percentual de rendimento da reação.
Q’r → quantidade de reagente que pode ser fornecido pelo problema ou que desejamos calcular.
Q’p → quantidade de produto que pode ser fornecido pelo problema ou que desejamos calcular.
Logo:
Qr → Qp xR(%)/100
Q’r → Q’p
01. A combustão completa do benzeno (C6H6) se processa de um rendimento de 95%. Qual é o volume de dióxido de carbono (CO2), obtido nas C.N.T.P., quando são consumidos 1,56 g de benzeno?
Dado: massas molares em g ⋅ mol–1: C6H6 = 78.
Resolução:
A fórmula do benzeno C6H6 nos sugere a seguinte proporção molar: 1 mol de C6H6 → 6 mol de CO2. Proporção entre as massas das substâncias envolvidas no problema: 78 g de C6H6→ 6 (22,4)L de CO2.
Identificação das Quantidades (Q):
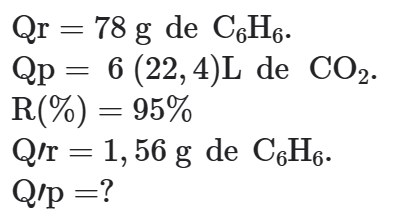
Logo:

NÁLISE ELEMENTAR POR REAÇÃO DE COMBUSTÃO COMPLETA (MÉTODO DE LIEBIG)
A combustão completa de compostos orgânicos, que apresentam no mínimo os elementos carbono e hidrogênio, formam como seus produtos as substâncias dióxido de carbono (CO2) e água (H2O). Desta forma, podemos entender que todo carbono presente na amostra analisada está relacionado com a produção de CO2, como também todo o hidrogênio com a produção de H2O.
Exemplo:
01. A combustão completa de 0,3 g de um composto X produziu 0,44 g de dióxido de carbono e 0,18 g de água. Determine a fórmula mínima de X.
Dadas as massas molares em g/mol: H = 1, C = 12, O=16, H2O=18, CO2=44.
a) Cálculo da massa de Carbono → x:
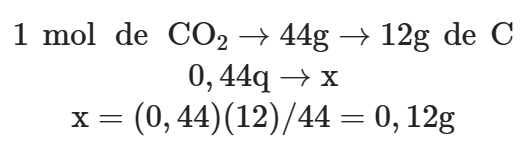
b) Cálculo da massa de Hidrogênio → y:
1mol de 2O → 18g → 2g de H
0,18g → Y
y=(0,18)(2)/18 = 0,02g
c) Cálculo da massa de oxigênio → z:
0,3 = x + y + z → 0,3 = 0,12 + 0,2 + z → z = 0,16g
ANÁLISE ELEMENTAR DE MISTURAS
Nesse caso, as reações deverão ser tratadas de forma independente. Depois se calculam as quantidades obtidas através de um sistema de equações.
Exemplo:
01. Uma liga metálica de massa igual a 1 g formada por magnésio e alumínio foi totalmente dissolvida em solução de ácido clorídrico, produzindo um gás. O volume do gás produzido, nas C.N.T.P. foi igual a 1,036 L.
Determine a composição percentual da liga.
Dadas Massas molares em g/mol: H = 1, Mg = 24, A𝓁 = 27, C𝓁 = 35,5, volume molar nas C.N.T.P. =22,4 L.
Resolução:
a) Equações Químicas e suas Proporções:
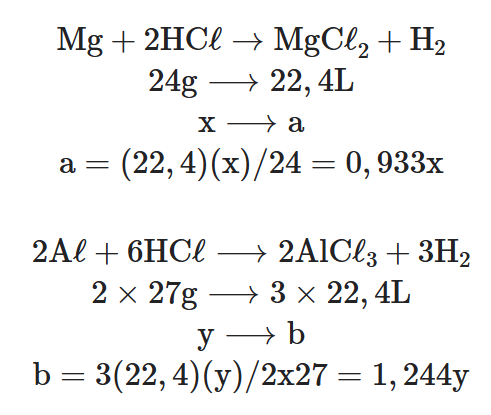
b) Sistema de Equação:
x + y = 1
0,933x + 1,244y = 1,036
Resolvendo o sistema, temos: x = 0,67 e y = 0,33, ou seja, 67% de Magnésio e 33% de Alumínio.




