Para realizar o balanceamento a partir desse método, segue-se os seguintes passos:
1º Destacar a variação do NOX dos elementos (Δ NOX);
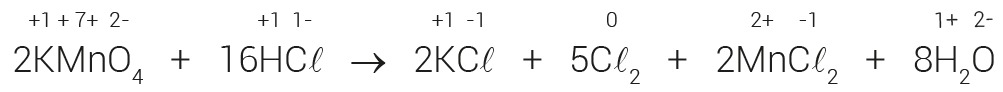
ΔNOX do Mn = |2−7| = 5
ΔNOX do C𝓁 = |1−0|=1
2º Escolher o lado para começar o balanceamento;
Começar pelo lado que tiver o maior número de átomos que participam da oxirredução. Se empatar, começar pelo lado com o maior número de substâncias.
No exemplo anterior, no lado dos reagentes existem 2 átomos que participam da oxirredução (1 átomo de Mn e um átomo de Cℓ). Já no lado dos produtos, temos no total 3 átomos participando da oxirredução (1 átomo de Mn e 2 átomos de Cℓ). Por essa razão, o lado escolhido para iniciar o balanceamento é o dos produtos.
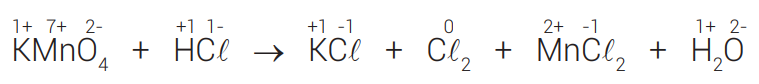
Agora, vamos multiplicar o ΔNOX, de cada um deles pelo número de átomos envolvidos que estão do lado escolhido para começar o balanceamento.
ΔNOX do Mn = 5×1 átomo envolvido = 5
ΔNOX do C𝓁 = 1×2 átomos envolvidos = 2
Sempre que puder, simplifique os valores encontrados para os menores números inteiros possíveis.
No exemplo dado, multiplica-se cruzado para igualar as quantidades de elétrons ganhos com elétrons perdidos.
ΔNOX do Mn = 5 × 1 = 5↘2
ΔNOX do C𝓁 = 1 × 2 = 2↗5
Colocar os valores encontrados na frente das substâncias que possuem os átomos envolvidos na oxirredução do lado escolhido para começar o balanceamento.
KMnO4 + HCℓ → KCℓ + 5ℓ2 + 2MnC2 + H2
Finalmente, terminar o balanceamento pelo método das tentativas.
2KMnO4 + 16HCl → 2KCℓ + 5C2 + 2MnC2 + 8H2O
Quando a reação de oxirredução for formada por íons, deve-se equilibrar também as cargas, de modo que o somatório das cargas dos reagentes seja igual ao somatório das cargas dos produtos.
Exemplo:
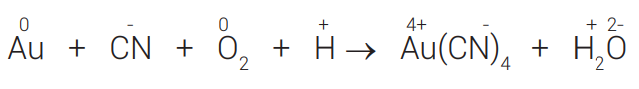
ΔNOX do Au = 3 × 1 = 3↘4
ΔNOX do O = 2 × 2 = 4↗3
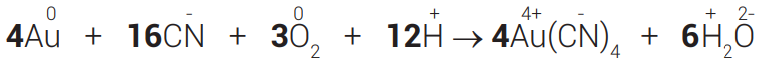
Repare que as massas já estão equilibradas, mas se faz necessário equilibrar as cargas.
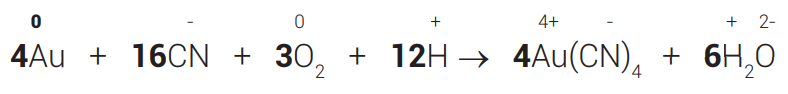
Reagentes: 4 × 0 + 16 × (−1) + 3 × 0 + 12 × (+1) = −4
Produtos: 4×(−1) + 6 × 0 =−4
Como as cargas estão iguais, a equação está balanceada.
AUTO-OXIRREDUÇÃO
Fenômeno no qual um mesmo elemento químico sofre oxidação e redução simultaneamente.
Exemplo:
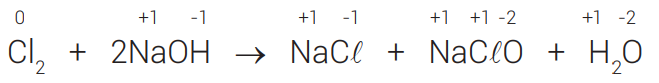
Observe que o Cℓ sofreu oxidação e redução, então pode-se afirmar que houve uma auto-oxirredução.
Nesse caso, o Cℓ2 é o agente oxidante e o agente redutor.




